2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+,然后测定其质荷比。某有机物样品的质荷比如图所示。该有机物可能是
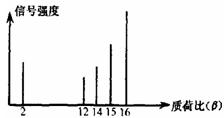
| A.甲醇 | B.甲烷 | C.丙烷 | D.乙烯 |
能用来鉴别Na2CO3和NaHCO3两种白色固体的方法是 ()
| A.分别取少量加入到石灰水中,观察有无沉淀生成 |
| B.分别取少量溶于水后,加入到入HCl溶液 |
| C.分别进行焰色反应,观察火焰的颜色 |
| D.分别取少量固体粉末分放在两支试管中,分别加热,将生成气体通入澄清石灰水中 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是()
| A.H+、Mg2+、Al3+ | B.Mg2+、Al3+、Fe3+ |
| C.H+、Ba2+、Al3+ | D.Na+、Mg2+、Al3+ |
设阿伏加德罗常数为NA,下列说法正确的是()
| A.在标准状况下,2.24 L H2O中含有0.1 NA个水分子 |
| B.0.1mol/LNaCl溶液中含有Na+子数为0.1NA |
| C.1molFe与足量盐酸完全反应, Fe失去的电子数为3NA |
| D.在标准状况下,1molH2含有的原子数为2NA |
取四线湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加浓硝酸、浓硫酸、新制氯水、浓氨水,四张试纸最后呈现的颜色是()
| A.白、黑、白、蓝 | B.白、红、白、蓝 | C.白、白、白、蓝 | D.红、黑、红、蓝 |
生产自来水是要用氯气消毒。市场上某些不法商贩为牟取暴利,用自来水冒充纯净水出售。为辨别真假,可用下列试剂来鉴别。该试剂是(C)
| A.酚酞 | B.氯化钠 | C.硝酸银 | D.氢氧化钠 |