道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是微小的实心球体;②同种原子的质量和性质都相同;③原子不能用物理方法分割。从现代原子——分子学说的观点看,你认为不正确的是
| A.只有① | B.只有② | C.只有③ | D.①②③ |
下列叙述不正确的是()
| A.含有金属元素的晶体不一定是离子晶体 |
| B.原子晶体中只存在共价键 |
| C.HF、HC1、HBr、HI四种物质的沸点依次升高 |
| D.金属晶体之所以能导电是因为其中含有自由移动的电子 |
纳米泡沫碳是一种固体单质碳,外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是()
| A.同一种物质 | B.同分异构体 | C.同系物 | D.同素异形体 |
NA表示阿伏加德罗常数的值,下列说法不正确的是()
| A.标准状况下,2.24 L O3所含有的电子数为2.4NA |
| B.含有NA个Na+的Na2O溶解于1L蒸馏水中,所得溶液中c(Na+)="l" mol/L |
| C.42 g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
| D.25℃,l L纯水中含有的H+数为l×10-7NA |
下列说法正确的是
| A.若发生A2+ 2D-=2A-+D2反应,则氧化性D2>A2 |
B.若X原子的质子数是a,中子数是b,则该核素可表示为  X X |
| C.若相同温度和浓度的两种钠盐溶液的碱性NaA<NaB,则酸性HA>HB |
| D.若主族元素的简单离子R 2-和M+的电子层结构相同,则原子序数R>M |
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al + 2OH-=2AlO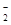 + H2↑ + H2↑ |
B.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2+ + CO2 ↑+ H2O ↑+ H2O |
C.氯气通入NaOH稀溶液中:Cl2 + 2OH-= Cl- + ClO-+ H2O + ClO-+ H2O |
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H++ SO + Ba2+ +OH-= BaSO4↓+ H2O + Ba2+ +OH-= BaSO4↓+ H2O |