按要求填空:
(1)碱金属元素原子半径最小的是 ,它作为新一代绿色可充电池的材料,放电时它是电池的 极(填“正”或“负”);卤族元素中原子最外层的电子数都是 个,在化学反应中它们容易得到 个电子。在卤族元素中非金属性最强的元素是 ,其离子的结构示意图: ;(每空1分,共6分)
(2)为防止碳素钢菜刀生锈,使用后特别是切过咸菜后,应采取的简易措施是 ;生活中和生产上最常用的燃料里所含的主要元素有_ ,它们在燃烧后生成的化合物主要是 。(每空2分,共6分)
(3)相对分子质量为58的烷烃的分子式是________,它可能的结构简式是 _________________、___________________(每空1分,共3分)
(4)已知某反应的各物质浓度数据如下: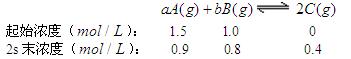
则①a= ,b 。
②2S内B的反应速率= 。
③3s末上述反应达平衡时,C浓度为0.6 mol/L,则A的转化率为 。
(5)丙烯通入溴水中褪色的化学方程式:_____________________(反应类型: __)
硝基苯生成的化学方程式:________________________(反应类型:____ )
分析下列反应,指出氧化剂和氧化产物。
(1)2Na2O2+2SO2══2Na2SO3+O2__________________________________。
Na2O2+SO2══Na2SO4__________________________________________。
(2)6Na+2FeCl3+6H2O══2Fe(OH)3↓+6NaCl+3H2↑________________________。
(3)3Fe(s)+4H2O(g)══Fe3O4(s)+4H2(g)___________________________。
请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)