在沥青中存在一系列结构相似的稠环芳香烃。这一系列化合物中的前三个同系物的结构简式如右图所示。
(1)萘的分子式是______________,芘的分子式是______________,蒽并蒽的分子式是______________。
(2)上述一系列化合物中,相邻两化合物分子式之差为CnHm,则n值为______________,m值为______________。
(3)这一系列有机物的通式可用含x的代数式来表示(x为自然数1,2,3,4…),则该通式为______________。
(4)随着x值的增大,这一系列化合物含碳的质量分数的极限数值为______________。
下已知A~K均为 中学化学中的常见物质,它们之间的转化关系如下图所示,其中A
中学化学中的常见物质,它们之间的转化关系如下图所示,其中A 、D为金属单质,反应过程中
、D为金属单质,反应过程中 生成的水及其他部分产物已略去。
生成的水及其他部分产物已略去。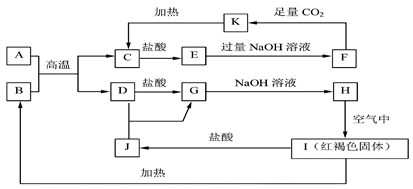
请回答以下问题:
(1)E中阳离子的结构示意图为 。
。
(2)CO2的电子式为。
(3)向F中通入足量CO2生成K的离子方程式
 。
。
(4)写出H在空气中生成I的化学方程式。
《有机化学基础》
(1)具有明显现象的官能团特征反应常被用来鉴定化合物。
①欲区分CH2 =CH2和CH3 CH3 ,应选用 __ (填字母)。
a.NaOH溶液 b.溴水 c.银氨溶液
②欲区分HCHO和HCOOH,应选用 _(填字母)。
a.KMnO4溶液 b.银氨溶液 c.Na2CO3溶液
③欲区分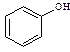 和
和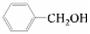 ,应选用 ___ (填字母)。
,应选用 ___ (填字母)。
a.FeCl3溶液 b.NaOH溶液 c.AgNO3溶液
(2)在有机化学中,同分异构是普遍存在现象。分子式为C4H9OH的有机物共有
种。其中,一种有机物通过消去反应可转变为2-丁烯,请写出该消去反应的化学方程式 ;另一种有机物的核磁共振氢谱图(1H核磁共振谱图)中显示一个峰,请写出该有机物的结构简式如下:。
;另一种有机物的核磁共振氢谱图(1H核磁共振谱图)中显示一个峰,请写出该有机物的结构简式如下:。
(3)A是石油裂解气的成分之一,A的某一同系物E的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成C6H12O2,其合成路线如下图所示: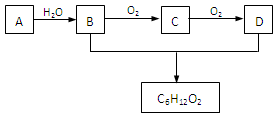
回答下列问题:
①A的结构简式为:______________。
②B、D分子中的官能团名称分别为_______________、_____________。
③写出B的同类别的同分异构体的结构简式:___________________。
④写出B→C的化学方程式:_______________________ __________________。
__________________。
《化学与生活》
(1)材料是人类赖以生存和发展的重要物质基础。
①生产水泥的主要原料是黏土和(填名称)。
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种。(选填“橡胶”或“纤维”或“塑料”)
③上海世博会中国馆用到一种涂料—氟碳涂层聚酯(FEP),它的单体为CF3—CF=CF2,这种涂料具有 (选填“热塑性”或“热固性”)。
(选填“热塑性”或“热固性”)。
④玻璃钢具有耐 腐蚀、质量轻、强度高的性能,它属于材料(选填“合金”或“复合”)。
腐蚀、质量轻、强度高的性能,它属于材料(选填“合金”或“复合”)。 (2)人体健康与食品、药物等关系密切。
(2)人体健康与食品、药物等关系密切。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取______________( 选填“
选填“ 脂肪”、“维生素”或“蛋白质”)不足引起的。
脂肪”、“维生素”或“蛋白质”)不足引起的。
②生活中应合理地摄取人体必需的元素,体内________含量过高,会引起甲状腺疾病。
③糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下水解为_______________________(写名称)。
④小苏打可用来治疗胃酸过多,请写出该反应的离子方程式
________________________________________ ___________。
___________。
⑤可以帮助流感病人解热镇痛的药物是______________(选填“青霉素”或“阿司匹林”)。
( 3)洁净安全的生存环境更是健康的保障。
3)洁净安全的生存环境更是健康的保障。
①为确保上海世博会期间城市空气质 量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是。
量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是。
a.可吸入颗粒物(PM10) b.NO2浓度 c.SO2浓度 d.CO2浓度
②可利用漂白粉对河水进行杀菌消毒,其能杀菌消毒的原因是漂白粉会与河水反应生成HClO(用化学反应方程式表示)是 。
。
③垃圾的无害化处理常用的方法包括卫生填埋和_________________焚烧。
④人们为追求时尚而把头发染成各种各样的颜色,常见的染发剂有植物染发剂、无机染发剂和_________________染发剂(选填“ 有机”“合成”或“复合”)。
有机”“合成”或“复合”)。
在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示的平均反应速率为_____ ____,A的转化率为______ ____。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度_________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入____ mol B物质。
(4)若向原平衡体系再投入1 mol A和1 mol B,平衡__________(填“右移、左移或不移”)。
(12分)某研究性小组进行如下实验:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?__________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____0.2 mol/L(填﹥、﹤或=)。混合液中离子浓度c(A-)c(Na+)(填﹥、﹤或=)。
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是________。
(填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。