绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下几种生产乙苯(反应均在一定条件下进行)的方法中符合绿色化学原理的是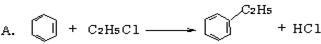
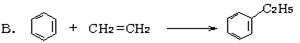

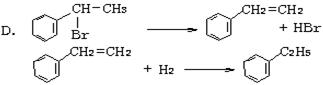
下列哪一个分子模型不属于比例模型:()
A.苯分子 |
B.乙醇分子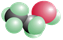 |
C.甲烷分子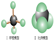 |
D.乙烯分子 |
下列说法中错误的是:()
①有机物都是从有机体中分离出来的物质②有机物都是含碳的共价化合物③有机物都不溶于水,极易溶于有机溶剂④有机物都不具备无机物的性质,都属于非电解质
| A.①③④ | B.③④ | C.②③④ | D.①②③④ |
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是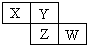
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
某些火箭和飞船升空所需的巨大能量可由下列化学反应提供:
C2H8N2 + 2N2O4 ="=" 2CO2↑ + 3N2↑ + 4H2O
有关该反应的说法正确的是
| A.该反应是分解反应 | B.反应中碳元素的化合价降低 |
| C.氧化剂是N2O4 | D.该反应不是氧化还原反应 |
用NA表示阿伏加德罗常数的值,下列说法错误的是
| A.在标准状况下22.4L H2中含有氢分子的个数为2NA |
| B.24g Mg变为Mg2+时失去的电子数为2NA |
| C.32g O2中含有氧原子的个数为2NA |
| D.1L 1 mol·L-1 NaCl溶液中含有钠离子的个数为NA |