关于化学键的下列叙述中,正确的是
| A.离子化合物不可能含共价键 | B.共价化合物可能含离子键 |
| C.离子化合物中只含离子键 | D.共价化合物中不含离子键 |
在实验室中,下列除去杂质的方法正确的是( )
| A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出碘 |
| B.乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 |
| C.硝基苯中混有浓硝酸和浓硫酸,将其倒入NaOH溶液中,静置,然后过滤 |
| D.乙烯中混有CO2,将其通入NaOH的溶液中洗气 |
甲烷分子中的四个氢原子都可以被取代。若甲烷分子中的四个氢原子都被苯基取代,则可得到如下分子,对该分子的描述,不正确的是( )
| A.分子式为C25H20 | B.所有碳原子都在同一平面上 |
| C.此分子属非极性分子 | D.此物质属芳香烃类物质 |
下列芳香烃的一氯代物的同分异构体数目最多的有( )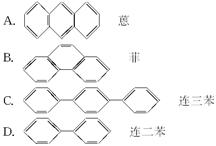
苯环结构中,不存在碳碳单键和碳碳双键的交替结构,可以作为证据的事实是()
①苯不能使KMnO4酸性溶液褪色;②苯中碳碳键的键长均相等;③苯能在加热和催化剂存在的条件下跟H2加成生成环己烷;④经实验测得邻二甲苯仅有一种结构;⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色
| A.②③④⑤ | B.①③④⑤ | C.①②④⑤ | D.①②③④ |
已知苯与一卤代烷在催化剂作用下可生成苯的同系物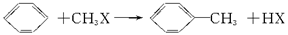
在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用( )
| A.CH3CH3和Cl2 | B.CH2==CH2和Cl2 |
| C.CH2==CH2和HCl | D.CH3CH3和HCl |