X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素原子的电子层结构时,X放出的能量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是
| A.Z2X | B.Z2Y | C.W2X | D.W2Y |
下列有关判断正确的是
| A.0.1mol/LNa2CO3溶液:c(Na+)= 2c(H2CO3)+2 c(HCO3-)+ c(CO32‾) |
| B.能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 |
| C.任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L |
| D.将0.2 mol·L-1的HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)= c(Na+) |
一定条件下,向密闭容器中加入X物质发生反应:3X(g)  Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是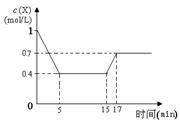
| 反应时间(min) |
0 |
5 |
15 |
17 |
20 |
| X的浓度(mol·L-1) |
1.0 |
0.4 |
0.4 |
0.7 |
0.7 |
A.0~5 min时,该反应的速率为v(Y)="0.04" mol·L-1·min-1
B.某时刻,X、Y、Z的浓度分别为:0.5mol•L‾1、0.3mol•L‾1、0.3mol•L‾1,则此时正反应速率大于逆反应速率
C.15 min时改变的条件可能是升高温度
D.从初始到18 min时,X的转化率为30 %
下列有关有机化学的说法中不正确的是
A.丙烯腈(CH2=CH—CN)经过加聚反应可制得人造羊毛的主要成分聚丙烯腈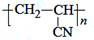 |
| B.用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 |
C.有机物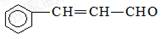 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 |
| D.乙烯、苯都含有不饱和键,所以都能使溴水、酸性高锰酸钾溶液褪色 |
下列有关实验操作、现象或原理均正确的是
| 选项 |
实验操作 |
实验现象或原理 |
| A |
将海带灼烧,加水浸泡后过滤,向滤液中加入CCl4,振荡后静置 |
液体分层,下层显紫红色 |
| B |
向氢氧化铝胶体中逐滴加入稀盐酸或氢氧化钠稀溶液 |
均先出现沉淀后溶解 |
| C |
将40.0gNaoH固体溶于1.0L蒸馏水中配成溶液 |
NaOH的物质的量浓度为1.0mol/L |
| D |
向BaSO4饱和溶液中加入饱和Na2CO3溶液 |
有白色沉淀产生,说明Ksp(BaSO4)大于Ksp(BaCO3) |
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8。下列说法错误的是
| A.Z元素的氧化物对应水化物的酸性一定弱于W |
| B.四种元素中Z的原子半径和形成的离子半径均最大 |
| C.X、Z、W中最简单气态氢化物稳定性最弱的是Z |
| D.X、Y、Z的原子均能与氢原子形成四原子分子 |