在同温同压下,下列各组热化学方程式中Q2>Q1的是 ( )
| A.2H2(g)+O2(g)====2H2O(g)ΔH=-Q12H2(g)+O2(g)====2H2O(l)ΔH=-Q2 |
| B.S(g)+O2(g)====SO2(g) ΔH=-Q1S(s)+O2(g)====SO2(g) ΔH=-Q2 |
C.C(s)+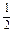 O2(g)="===CO(g)" ΔH=-Q1C(s)+O2(g)====CO2(g) ΔH=-Q2 O2(g)="===CO(g)" ΔH=-Q1C(s)+O2(g)====CO2(g) ΔH=-Q2 |
D.H2(g)+Cl2(g)="===2HCl(g)" ΔH=-Q1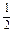 H2(g)+ H2(g)+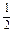 Cl2(g)="===HCl(g)" ΔH=-Q2 Cl2(g)="===HCl(g)" ΔH=-Q2 |
3He与4He互为同位素,下列说法不正确的是
| A.3He与4He具有相同的中子数 | B.3He与4He具有相同的质子数 |
| C.3He与4He具有相同的最外层电子数 | D.3He与4He具有不同的质量数 |
 分析下列各组物质,互为同系物
分析下列各组物质,互为同系物 A.金刚石和C60 B. CH4与CH3CH3
A.金刚石和C60 B. CH4与CH3CH3

将标准状况下的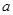 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·/mL,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·/mL,则该盐酸的物质的量浓度是
A.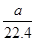 mo1·L-1 mo1·L-1 |
B.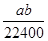 mol·L-1 mol·L-1 |
C.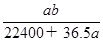 mol·L-1 mol·L-1 |
D. mol·L-1 mol·L-1 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
| A.2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
| B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
| C.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA |
| D.22.4 L的CO气体与1 mol N2所含的电子数相等 |
30mL 1mol/L NaCl溶液和40mL 0.5mol/L CaCl2溶液混合后,混合液中Cl-浓度为
| A.0.5mol/L | B.0.6mol/L | C.1 mol/L | D.2 mol/L |