镁和铝分别与等浓 度、等体积的过量稀硫酸反应,产生
度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
气体的体积(V)与时间(t)关系如右图。反应中镁和铝的

| A.转移电子数之比为2︰3 | B.摩尔质量之比为2︰3 |
C.物质的量之比为3︰2 | D.反应速率之比为2︰3 |
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与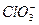 的浓度比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为()
的浓度比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为()
| A.21∶5 | B.11∶3 | C.3∶1 | D.4∶1 |
下列实验操作正确的是()
| A.将氢氧化钠固体放在滤纸上称量 |
| B.用10 mL量筒量取8.58 mL蒸馏水 |
| C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
| D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
葡萄糖的分子式为C6H12O6,通过缩合反应把10个葡萄糖分子连接起来所形成的链状化合物的分子式为()
| A.C60H120O60 | B.C60H100O52 | C.C60H102O51 | D.C60H112O51 |
在100mL12mol·L-1的浓HCl中加入足量的MnO2加热,充分反应后得到Cl2的物质的量是()
| A.0.6 mol |
| B.在0.3 —0.6 mol之间 |
| C.0.3 mol |
| D.小于0.3 mol |
下列说法不正确的是()
| A.氯气是黄绿色的有毒气体,氯离子是无色、无毒、比氯原子结构稳定的粒子 |
| B.氯原子易得电子,所以在化学反应中,氯元素化合价只会降低 |
| C.新制的饱和氯水中,除水分子外,较多存在的粒子是Cl2分子 |
| D.铜在氯气中燃烧生成棕黄色烟 |