下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
| C.金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H2+O2 ="==" 2H2O下列有关说法正确的是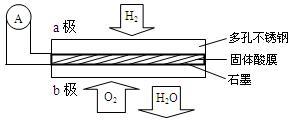
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-="==" 4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
下列说法正确的是
| A.pH = 3的盐酸和pH = 5的硫酸等体积混合,pH = 4 |
| B.室温下,pH = 9的碱性溶液中,可能存在CH3COOH分子 |
| C.中性溶液中必然有c(H+) = c(OH-) = 1×10-7 mol/L |
| D.在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
用来表示可逆反应:2A(g)+B(g)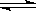 3C(g)(正反应放热)的正确图象是下图中的
3C(g)(正反应放热)的正确图象是下图中的

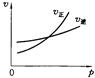

A B C D
在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1AgNO3溶液时,最先和最后沉淀的物质是(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
| A.AgBr、AgCl | B.Ag2CrO4、AgCl |
| C.AgBr、Ag2CrO4 | D.同时沉淀 |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2 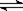 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |