现有10种元素的性质、数据如下表所列,它们均为短周期元素。
| |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
0.102 |
0.037 |
| 最高或最低 化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
+6 |
+1 |
| -2 |
|
|
-3 |
-1 |
|
-3 |
|
-2 |
|
回答下列问题:
(1)D的元素名称是 ,
H的元素符号是 。
B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是 。
化合物F2A2的电子式是: ,构成该物质的化学键类型为________________
(3)用电子式表示A的简单氢化物的形成过程如下: ;
G的氢化物的结构式为 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6 kJ热量,写出其热化学方程式 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:____________________。
若将苯倒入盛有溴水的试管中,振荡后静置,现象是,说明苯;若将碘晶体、食盐固体分别加入盛有苯的试管中,振荡后静置,现象是。
干电池是一种的装置。干电池外围的锌皮是电池的极,发生(“氧化” 或“还原” )反应;中间碳棒是电池的极,发生(“氧化” 或“还原” )反应。
有机物D对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。有机物D可以用下面的设计方案合成。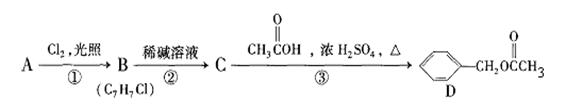
(1)A的结构简式:,C的名称:。
(2)写出反应②的化学方程式:。
(3)写出反应③的化学方程式:。
(4)请写出三个同时符合下列条件的D的同分异构体:
A、属于芳香酯类;B、苯环上只有一个侧链。
。
取8 g某有机物A,完全燃烧后只生成11gCO2和9g H2O。回答下列问题:
(1)A分子中(填:“是”或“不”)含氧元素。理由是(用数据说明)。
(2)A 的实验式(最简式)为:。
(3)A的分子式能否确定?(填:“能”或“否”),理由是
。
(1)在做淀粉水解实验过程中,若想证明淀粉已经水解,可以取水解液少许先中和后再加入并加热至沸腾,现象为;若想证明淀粉只是部分水解,可以加入,现象为。
(2)做银镜反应配制银氨溶液时,把滴入到只至为止。