一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z (s),以下能说明作为反应达到平衡标志的是 ( )
Y(g)+Z (s),以下能说明作为反应达到平衡标志的是 ( ) 
| A.X的分解速率与Y的消耗速率相等 | B.X、Y与Z的物质的量之比为2:1:1 |
| C.混合气体的密度不再变化 | D.单位时间内生成lmolY的同时分解2mol X |
在一定温度和压强下,1体积的A2气体和3体积B2气体化合成2体积的C气体,则C的化学式为( )
A.AB3 B.AB C.A3B .A2B3
在150 ℃时,加热高氯酸铵发生分解反应:2NH4ClO4====N2↑+Cl2↑+2O2↑+4H2O↑,其气态生成物组成的混合气的平均相对分子质量为( )
| A.40.75 | B.29.375 | C.14.69 | D.无法计算 |
在一定条件下,氯气可与氯化铵发生如下反应
xCl2+yNH4Cl====yNClx+(x+y)HCl
当消耗6.72 L标准状况下的氯气时,生成0.100 mol氮的氯化物,则此氮的氯化物的化学式为 ( )
| A.NCl2 | B.NCl3 | C.NCl4 | D.NCl5 |
某气体分子的质量为a g,则标准状况下b g该气体的体积是(式中NA为阿伏加德罗常数)( )
A.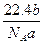 L L |
B.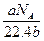 L L |
C.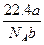 L L |
D.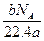 L L |
阿伏加德罗定律能够成立的本质原因是在一定的温度和压强下( )
| A.气体的体积只随分子数的多少而变化 |
| B.不同气体分子的大小几乎相等 |
| C.不同气体分子间平均距离几乎相等,且分子的大小忽略不计 |
| D.不同气体的摩尔质量不相同 |