下图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和。下列说法正确的是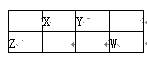
| A.X元素形成的气态氢化物分子的空间结构是三角形 |
| B.Z与Y元素形成的化合物可以是原子晶体 |
| C.W单质受热蒸发时吸收的热量用于克服共价键 |
| D.Z的最高价氧化物能溶于W的最高价氧化物的水化物中 |
已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:
2CH3CH2Br+2Na―→CH3CH2CH2CH3+2NaBr;应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
| A.CH3Br | B.CH3CH2CH2CH2Br |
| C.CH2BrCH2Br | D.CH3CHBrCH2CH2Br |
除去苯中所含的苯酚,可采用的适宜方法是
| A.加70 ℃以上的热水,分液 | B.加适量浓溴水,过滤 |
| C.加足量NaOH溶液,分液 | D.加适量FeCl3溶液,过滤 |
能把苯、四氯化碳、己烯、丙醛四种物质区别开来的一种试剂是
| A.水 | B.溴水 | C.FeCl3溶液 | D.银氨溶液 |
新型弹性材料“丁苯吡橡胶”的结构简式如下: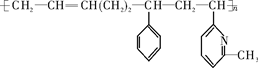
其单体可能是下列6种的几种:
CH2CCH3CHCH2②CH2=CH—CH=CH2③C6H5CH=CH2
④CH3CHCHCH2⑤CH2=CHC5H3NCH3⑥CH2CHNCH3
正确的组合是
| A.②③⑥ | B.②③⑤ | C.①②⑥ | D.②④⑥ |
下列变化中,属于化学变化的是
| A.石油分馏 | B.煤的干馏 |
| C.苯中加入溴水 | D.煤焦油中提取苯、甲苯、二甲苯等产物 |