运用化学反应原理研究氮、氧、镁、铜等元素及其化合物的性质。 ⑴合成氨反应反应:N2(g)+3H2(g)
⑴合成氨反应反应:N2(g)+3H2(g) 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。 ⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
⑵在25℃下,将aL,0.01mol·L-1的氨水加入到1L,0.01mol·L-1的盐酸溶液中,若反应后溶液中c(NH4+)>c(Cl-),则溶液显____性(填“酸”“碱”或“中”)。若a>1,反应所得溶液中下列离子浓度比较可能正确的是
①Cl->H+>NH4+>OH-;②Cl->NH4+>H+>OH-;③Cl-=NH4+>H+=OH-;④NH4+>Cl->OH->H+ ⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
⑶在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生
成_______沉淀(填化学式),生成该沉淀的离子方程式为_________________________;继
续滴加氨水,最后一步发生的反应的离子反应方程式
参考数据:25℃,Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
⑷有人设想寻求合适的催化剂和电极材料,以N2和H2为电极反应物,以HCl-NH4Cl为电
解质溶液环境制备新型燃料电池。则该燃料电池负极附近的pH____(填“增大”、“减小”或“不变”);正极的电极反应方程式为________ _____
在T℃下,将1 mol N2和3 mol H2的混合气体通入固定体积为2L的密闭容器内,起始压强为101KPa,经过30s达到平衡,测得平衡混合气体的平均相对分子质量为10。试求:
此反应过程中N2的平均反应速率为_____________________________。
H2的转化率为_____________________。
维持一定温度和压强不变,在起始体积为2L的体积可变的容器中充入1 mol N2、3 mol H2,达平衡时N2的转化率与上述平衡相等,则该平衡时,容器的体积为_____________L。
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2)YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3)在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4)已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系: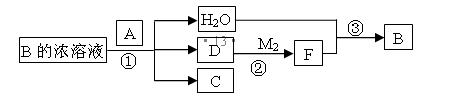
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
a、b、c、d、e、f是原子序数依次增大的前20号元素,其中只有f为金属元素,a是周期表中原子半径最小的元素,b的最外层电子数为电子层数的两倍,d、e同主族,且d是地壳中含量最多的元素。试回答下列问题:
(1)a与f的单质可按1∶1化合,试用电子式表示其形成过程________________。
(2)a与d形成的化合物中有一种称为“绿色氧化剂”。写出酸性条件下该化合物与FeSO4溶液反应的离子方程式:___________________________________。
(3)be2的结构式为________________________,它是一种常见的溶剂,通常条件下1克该物质完全燃烧会释放出7.8 kJ的热,试写出该物质燃烧热的热化学方程式:
______________________________________________________________。
(4)标准状况下c的氢化物溶解度为700,用c的氢化物做喷泉实验后所形成的溶液密度为ρ g/cm3,该溶液的物质的量浓度C = ______________;溶质质量分数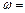 ______________(此空用数据列出表达式即可)。
______________(此空用数据列出表达式即可)。
某无色溶液可能含有Na+、Ba2+、NH4+、CO32-、SO32-、NO3-、SO42-、I-等离子。为鉴定这些离子,分别取少量溶液进行以下实验:
①取样品进行焰色实验,焰色呈黄色;
②取样品加BaCl2溶液,立即产生白色沉淀。过滤后,向白色沉淀中加入足量盐酸,沉淀部分溶解;
③取样品加入少量淀粉溶液,再加入过量氯水,无明显现象;
④取样品加入足量稀H2SO4,生成无色气体。该气体不能使澄清石灰水溶液变浑浊,但遇空气后立即变成红棕色;
分析上述4个实验,回答下列问题。
(1) 该溶液中肯定不含的离子是,不能确定的离子是;
(2) 写出第④步中加入稀H2SO4生成气体的离子方程式;
(3) 设计实验检验第(1)题中不能确定的离子:取样品于试管中,
,则说明含有该离子。
某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种离子。
①该溶液的焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
(1)该溶液中一定含有(填离子的化学式)离子,一定不含有的离子有(填离子的化学式);
(2)①根据图中所示数据,计算实验中使用的NaOH溶液的物质的量浓度
为:
②在配制实验所需100mL NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需
要(填仪器名称)。
(3)根据图示信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为: