能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____,该反应是____(填“氧化”或“还原”)反应;
②当电解质溶液为浓硝酸时:
Cu电极是_____极,其电极反应为__________,该反应是_____反应.
(2)电解是将 能转化为 能。请写出电解硫酸铜溶液的总化学方程式____________
(3)燃烧氢气时耗氧量小,发热量大.已知4克H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为: .
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式 。
2003年6月5日世界环境日的主题是:“水——二十亿人生命之所系”。节约用水,防治水污染具有十分重要的意义。某工厂有甲、乙、丙三个车间,各自排放的污水中均无沉淀物。各车间的污水分别含有以下六种物质中的各两种:KOH、K2SO4、AgNO3、Ba(NO3)2、KCl、HNO3。为防止污染水源,某中学化学兴趣小组配合工厂分别用石蕊试液和氯化钡溶液进行污水检测,现象如下:
甲:蓝色(石蕊试液)、白色沉淀(氯化钡溶液);乙:紫色(石蕊试液)、无明显现象(氯化钡溶液);丙:红色(石蕊试液)、白色沉淀(氯化钡溶液)。
由此可确定丙车间排放的污水中含有和。为变害为利,化学兴趣小组与工厂研究设计如下图污水处理方案。请回答:沉淀A是,若各步处理均完全反应,最终排放液C的溶质是,在农业上它可用作复合肥料。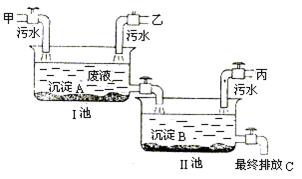
下列物质中属于强电解质的是_____________,属于弱电解质的是________。
| A.H2O | B.CH3COOH | C.NaHCO3 |
| D.BaSO4E.H2SO3F.H2SO4 |
下列物质属于电解质的是____________________(填编号)。
①Zn ②NaCl(s) ③Na(s) ④酒精 ⑤H2SO4(l) ⑥NH3 ⑦SO2 ⑧NaOH(s) ⑨C(石墨固体) ⑩Na2O
某溶液中可能含有H+、Na+、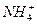 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、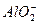 、
、 、
、 、
、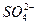 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是______________,气体B的成分是_______________。(填化学式)
(2)X溶液中一定存在的离子是_______________。
(3)写出步骤①中发生反应的所有的离子方程式_______________。
(4)写出步骤②中形成白色沉淀甲的离子方程式_______________。
(5)通过上述实验,白色沉淀乙的组成可能是_______________;只要设计一个简单的后续实验就可以确定该沉淀的组成,该方法是______________________________。