样品中Al的质量分数为 (用小数表示,小数点后保留两位)。
该小组为了测定其中Al2O3的含量,从上面反应后的100mL溶液中,取出10mL溶液,逐滴加入1mol/L的盐酸,当滴到5.00mL时开始产生沉淀,继续滴加盐酸,至25.00mL时沉淀恰好全部溶解。
(1)键线式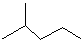 表示的分子式___________;名称是___________。
表示的分子式___________;名称是___________。
(2) 中含有的官能团的名称为___________________。
中含有的官能团的名称为___________________。
(3)丁基的4个结构简式为___________________________; ___________________________;___________________________;___________________________。
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_________、_________、尾接管、锥形瓶。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为__________________________________________。
(2)阴极上的电极反应式为__________________________________________。
(3)原上层液体是____________________ 。
。
(4)原下层液体是______________
(5)搅拌后两层液体颜色发生变化的原因是___________________________
(6)要检验上层液体中含有的金属离子,其方法是___________________,现象是_______________________________________________________。
(5分)浓度均为0.1mol/L的8种溶液:① HN O3② H2SO4③ CH3COOH④ Ba(OH)2⑤ NaOH⑥ CH3COONa⑦ KCl⑧ NH4Cl,溶液PH由大到小的顺序是(填写编号)_________________________________
O3② H2SO4③ CH3COOH④ Ba(OH)2⑤ NaOH⑥ CH3COONa⑦ KCl⑧ NH4Cl,溶液PH由大到小的顺序是(填写编号)_________________________________
(1 2分)由环己烷可制得1, 4 – 环己
2分)由环己烷可制得1, 4 – 环己 二
二 醇,下列有7步反应(其中无机产物都已略去),试回答以下问题:
醇,下列有7步反应(其中无机产物都已略去),试回答以下问题: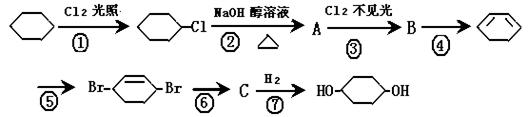
(1) 上述反应中属于取代反应有。
(2) 化合物的结构简式:B,C;
(3) 反应④所用试剂和条件是;
(4) 写出反应②、⑤的化学方程式:反应②;
反应⑤。
为测定某卤代烃的组成, 某同学设计实验如下:①量取该卤代烃液体11.4mL, 加入适量NaOH溶液, 加热反应至液体不分层;②冷却后用稀硝酸酸化, 再加入过量硝酸银;③过滤沉淀, 洗涤沉淀2~3次;④将沉淀干燥后称重。
回答下列问题:
(1)①中加入NaOH的目的是____________________________________________________
(2)②中加入过量硝酸银的目的是______________________________________________
(3)若②中生成的沉淀为淡黄色, 则该卤代烃中的卤原子是________
(4)若称得沉淀的质量为37.6g, 又测得卤代烃的密度为1.65g·mL-1, 其蒸气密度是相同条件下氢气密度的94倍。则该卤代烃分子中含有________个卤原子。
(5)写出该卤代烃可能的结构简式和名称:_________________