铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
⑴超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中所含的化学键有 、 、 ,
N、O、S三种元素的第一电离能大小顺序为: > > 。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为: 。
③ NH3分子中N原子的杂化方式为: 。
④与SO2互为等电子体的分子有 (写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通人一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________。
②CuCl的熔点比CuO的熔点 。(填“高”或“低”)
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
(1)某同学为研究该实验,查阅有关资料得到如下数据:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?(填“合理”或“不合理”)
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是,反应的离子方程式为。
③实验室溶解该熔融物,下列试剂中最好的是(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
(2)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价就越低。某同学取 一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系
一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系 如下图所示。
如下图所示。
回答下列问题:
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
上述现象说明溶液中、、结合OH-的能力比强(填离子符号)。
③B点与A点的差值为摩尔。
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
某化学兴趣小组模拟该处理过程的实验装置如 下:
下: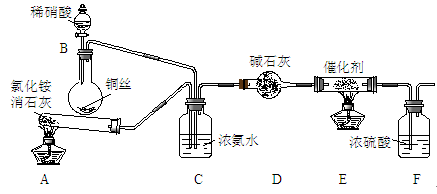
①假如需要检验装置A中产生的气体,请写出一种常用方法。
②装置C的作用是。
③写出装置F中发生反应的离子方程式。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应,
NO + NO2 + Na2CO3 = 2NaNO2 + CO2(I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2(II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是(填字母)。
A.1.9 B.1.3 C.1.2 D 1.6
②将1mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示: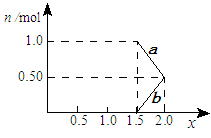
图中线段b表示离子随x值变化的关系;若用溶质质量分数为20.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加40g,则NOx中的x值为。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是。
在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断: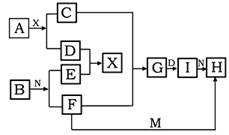
(1)写出下列化学式 AI
(2)F+M→H离子方程式为
(3)A+X→C+D的化学方程式为__________ _____________________
《化学与生活》
(1)人体健康与食品等关系密切。
①生活中应合理地摄取人体必需的元素,体内________ 含量过高,会引起甲状腺疾病[
②。糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下最终水解为_______________________(写名称)。
③棉花纤维的化学成分是(写化学式)。
(2)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点。
②黄铜(铜锌合金)外观和金(Au)相似,常被误认为黄金。
试写出一种鉴别黄铜与黄金的化学方法。铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式;用盐酸可以除去铜器表面的铜绿,该反应的化 学方程式为。
学方程式为。
③下列对金属制品采取的防护方法不正确的是(填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
(3)生活处处有化学,化学与生产、生活密切相关。
①小孩误服重金属盐后,应立即,以减少人体蛋白质中毒的程度。
②食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性。亚硝酸钠属于(选填“调味剂”、“防腐剂”或“着色剂”)。
③维生素C的结构为


 它是一种水溶性的维生素,缺乏VC会使人患上病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现,说明新鲜水果中含有VC,这是利用VC具有(填
它是一种水溶性的维生素,缺乏VC会使人患上病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现,说明新鲜水果中含有VC,这是利用VC具有(填 “氧化”或“还原”)性质。
“氧化”或“还原”)性质。
④乙酰水杨酸( )的俗名为阿司匹林,是常用药。它遇水能缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为
)的俗名为阿司匹林,是常用药。它遇水能缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为 。
。
核能源已日益成为当今世界的主要能源。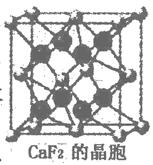
(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2 (CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如图),则UO2晶体U4+的配位数为;
 |
三碳酸铀酰铵中含有化学键类型有;
A.离子键 B.σ键 C.π键 D.氢键 E.配位键
根据价层电子对互斥理论推测CO32-的空间构型为;写出一种与CO32-互为等电子体且属于非极性分子的微粒的化学式。
(2)为了获得高浓度的235U,科学家们采用“气体扩散法”:到目前为止,UF6是唯一合适的化合物。UF6在常温常压下是固体,在56.4℃即升华成气体。UF6属于晶体。’
(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以作为核爆炸或核反应堆泄漏事故的信号核素 。写出131I基态原子的价电子排布式。
。写出131I基态原子的价电子排布式。