化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为_______________________;
,常用作脱氯剂,该反应的离子方程式为_______________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式: ________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式: ________________、_________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式: 。
钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2 TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
(1)针对以上五个反应,下列叙述错误的是________。
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析正确的是________。
A.钛是像金、铂一样的不活泼金属
B.金属钛的表面易形成致密的氧化膜
C.钛与氧气、酸等腐蚀剂不反应
D.钛有很高的强度
铁是地壳中含量很丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参与的两个反应的化学方程式:
___________________________。
(2)写出赤铁矿被CO还原成铁的化学方程式:________________。
(3)实验室中可用CO还原Fe2O3,在加热Fe2O3前应________,直到无________现象时才能点燃酒精灯加热,否则可能发生________现象,未反应完全的CO________(填“能”或“不能”)排放到大气中,应做________处理。
糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。
(1)蛋白质、淀粉、脂肪三种营养物质中水解的最终产物能与新制Cu(OH)2悬浊液反应的是________,制造肥皂的主要原料是________。
(2)蛋白质水解的最终产物是____________。
(3)下列有关说法中正确的是____________。
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.糖类并不都有甜味
D.糖类、油脂、蛋白质都能发生水解反应
(4)淀粉溶液和蛋白质溶液都是胶体,用一束光通过其溶液,都产生____________,若检验它们可选用的试剂是____________。
有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。
(1)有下列几种食品:
①花生油中所含人体所需的主要营养物质为________(填“糖类”“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了________反应(选填下列选项号)。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
某学生做淀粉水解实验,步骤如下: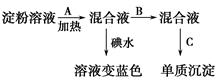
(1)写出淀粉水解的化学反应方程式_______。
(2)单质沉淀是________________(写化学式)。
(3)填写所加试剂名称及其作用:
A.____________,作用_______________________;
B.____________,作用_____________________。