下列化学用语表达正确的是
A.三氧化硫分子比例模型:  |
B.次氯酸分子的电子式: |
| C.基态硫原子的价电子排布:2s22p4 | D.质量数为37的氯原子:17 37Cl |
一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和 H2O的总质量为27.6 g,其中H2O的质量为10.8 g,则CO的质量是
| A.1.4 g | B.2.2 g |
| C.4.4 g | D.在2.2 g和4.4 g之间 |
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) 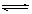 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是()
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,B极表面有大量气泡产生;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D经导线流向C;③A、C相连后,同时浸入稀H2SO4溶液中,H+向C极迁移;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺 序是
序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
'X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的三倍,下列说法正确的是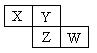
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |