碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
a |
b |
c |
1 |
①实验1中,以v(H2)表示的平均反应速率为 。
②该反应的正反应为 (填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是 ;溶液中所含离子的物质的量浓度由大到小的顺序为: 。
聚酰胺-66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:
已知反应:
(1)能与银氨溶液反应的B的同分异构体的结构简式为,
(2)
的结构简式为,①的反应类型为,
(3)为检验
中的官能团,所用试剂包括NaOH水溶液及
(4)由 和 生成H的反应方程式为
。
卤族元素包括
等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是。
(2)利用"卤化硼法"可合成含
和
两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有
原子的个数为,该功能陶瓷的化学式为。
(3)
和
中心原子的杂化方式分别为和。第一电离能介于
、
之间的第二周期元素有种。
(4)若
与
通过
原子与
原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是。
废旧硬质合金刀具中含碳化钨(
)、金属钴(
)及少量杂质铁,利用电解法可回收
和
。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,
溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液I的主要成分是。洗涤
不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将
还原成
粉的化学反应方程式为。
化学反应原理在科研和生产中有广泛应用
(1)利用"化学蒸气转移法"制备TaS2晶体,发生如下反应
(Ⅰ)反应(Ⅰ)的平衡常数表达式
=,若
=1,向某恒容密闭容器中加入1
和足量
,
的平衡转化率为,
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为
的一端放入未提纯的
粉末和少量
,一段时间后,在温度为
的一端得到了纯净的
晶体,则温度
(填"﹥""﹤"或"=")。上述反应体系中循环使用的物质是。
(3)利用
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为
,然后用一定浓度的
溶液进行滴定,所用指示剂为,滴定反应的离子方程式为,
(4)25℃时,
的电离常数
,则该温度下
的水解平衡常数
=
,若向
溶液中加入少量的
,则溶液中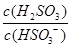 将(填"增大""减小"或"不变")。
将(填"增大""减小"或"不变")。
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是,
a.
b.
c.
d.
(2)辉铜矿(
)可发生反应
,该反应的还原剂是,当1
发生反应时,还原剂所失电子的物质的量为
。向
溶液中加入镁条时有气体生成,该气体是。
(3)下图为电解精炼银的示意图,(填"
"或"
")极为含有杂质的粗银,若
极有少量红棕色气体产生,则生成该气体的电极反应式为,
(4)为处理银器表面的黑斑(
),将银器置于铝制容器里的食盐水中并与铝接触,
转化为
,食盐水的作用为。