元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有()
| A.3种 | B.6种 | C.9种 | D.12种 |
下列电子式中错误的是()
| A.Na+ | B. |
C.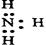 |
D. |
下列晶体或分子中,含有化学键类型有差异的一组是()
| A.H2O、CO2 | B.MgF2、H2O2 | C.NaOH、Ba(OH)2 | D.NaCl、KCl |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 3B(g)  2C(g) ΔH="-192" kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
2C(g) ΔH="-192" kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是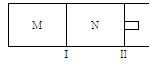
| A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B.若x∶y=1∶2,则平衡时,M中的转化率:A>B |
| C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v(正)<v(逆) |
常温下,下列各溶液的叙述中正确的是
| A.pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-) |
| B.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b |
| C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性 c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) |
| D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中, |
[c(Na+)-c(F一)]<[c(K+)-c(CH3COO一)]