在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0
CO2(g)+H2(g) ΔH <0
已知CO的浓度变化如图所示。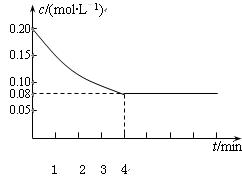
⑴从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反应的平衡常数为 。
⑵为了增大CO的转化率,可以采取的措施有 。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L。
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
药物E具有抗癌抑菌功效,其合成路线如下。
已知:NaBH4是一种很强的还原剂,可以将-C N还原为-CH2NH2
N还原为-CH2NH2
(1)关于化合物D的说法错误的是_______________
a.1molD最多可与3molH2发生加成反应 b.可以与盐酸发生反应
c.可以使高锰酸钾酸性溶液褪色 d.是烃的含氧衍生物
(2)反应③在水溶液中进行,HCl是催化剂,此反应中除了生成D外,还有一种产物,该产物的名称是_________________。
(3)E的结构简式为______________________。
(4)合成路线中设计反应①和③的目的是____________________________________________
(5)阅读以下信息,依据以上流程图和所给信息,以CH3CHO和CH3NH2为原料设计合成α-氨基丙酸【CH3CH(NH2)COOH】的路线。
已知:
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A→B→C…→H.
已知有机物M中只含有C、H、O三种元素,其相对分子质量为88。与M有关的反应如下:
已知:
请按要求回答下列问题:
(1)M的分子式为_________,其分子中除碳氧双键外的官能团的名称为_______________。
(2)写出①、③的反应类型:①_______________________,③_______________________。
(3)E的名称___________,检验D中官能团的试剂是___________。
(4)写出反应②的化学方程式:____________________________________________;
(5)X是M的同分异构体,且X属于酯类,其结构简式有__________种,请写出只含一个甲基的结构简式:__________________。
多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I SO2+2H2O+I2→H2SO4+2HI
II 2HI H2+I2
H2+I2
III 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2Od.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。
0—2min内的平均反应速率v(HI)= _________。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。