如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。根据图示判断,下列结论中不正确的是( )。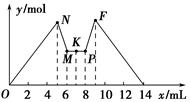
| A.N点时溶液中的溶质只有NaCl |
| B.M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C.c(NaOH)=c(HCl) |
| D.原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1 |
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
| A.0.5a mol | B.(0.1+a)mol |
| C.0.1a mol | D.2a mol |
下列说法正确的是
| A.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| B.向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 |
| C.向氯水中加入Na2CO3可使溶液中c(HClO)增大 |
| D.室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变 |
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑
② 
③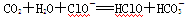
④ ,
,
由此得出的如下结论中不正确的是
A.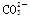 与H+、Ca2+不能大量共存 与H+、Ca2+不能大量共存 |
| B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 |
| D.H2CO3、HClO都属于弱酸 |
下列溶液一定呈中性的是
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.滴入酚酞显无色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |