世博会上澳大利亚馆的外墙采用的是特殊的耐风化钢覆层材料,外墙的颜色每天都在发生着变化,它会随空气中太阳、风雨、湿度的影响,逐渐结出一层锈斑,从橙色到赭红色的转变,看上去外观的生锈程度在增加,运用了钢材生锈原理。下列有关钢材生锈的说法正确的是 
| A.红色铁锈的主要成分是Fe(OH)3 |
| B.钢材在空气中的变化只有氧化还原反应 |
| C.钢材在空气中的腐蚀主要为电化腐蚀,其负极的反应为:Fe-3e-=Fe3+ |
| D.空气中太阳、风雨、湿度对钢材的腐蚀有影响 |
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是
| A.该溶液一定是由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(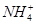 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c( )
)
B.0.1 mol·L-1 NH4HS溶液中:c(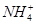 )=c(HS-)+c(H2S)+c(S2-)
)=c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c( )=c(
)=c( )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是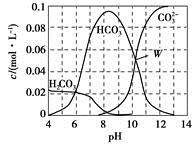
A.W点所示的溶液中:c(Na+)+c(H+)=2c(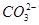 )+c(OH-)+c(Cl-) )+c(OH-)+c(Cl-) |
B.pH=4的溶液中:c(H2CO3)+c(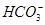 )+c( )+c(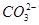 )<0.1 mol·L-1 )<0.1 mol·L-1 |
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(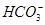 )=c(OH-)+c(Cl-) )=c(OH-)+c(Cl-) |
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(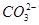 )>c( )>c(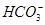 )>c(H2CO3) )>c(H2CO3) |
下列有关物质浓度关系的描述,正确的是
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(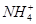 )>c( )>c(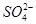 )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(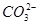 )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度: |
c(CH3COONa)> c(Na2CO3)>c(C6H5ONa)>c(NaHCO3)
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c(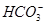 )+c(H2CO3) )+c(H2CO3) |
B.当V=5时,c(Na+)+c(H+)=2c( )+c( )+c(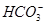 )+c(OH-) )+c(OH-) |
C.当V=10时,c(Cl-)=c( )+c( )+c(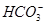 )+c(H2CO3) )+c(H2CO3) |
D.当V=15时,c(Na+)=c(Cl-)>c(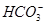 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |