在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题: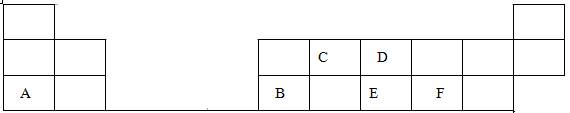
(1)画出D的原子结构示意图 ;
(2)写出C的最高价氧化物的电子式 ;
(3)E和F分别形成的气态氢化物中最稳定的是 (填写氢化物的化学式)
(4)A最高价氧化物的水化物的化学式 。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行: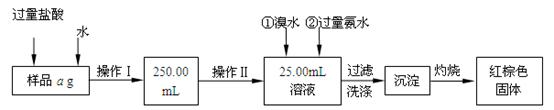
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是
Ⅱ.有同学提出,还可以采用以下方法来测定: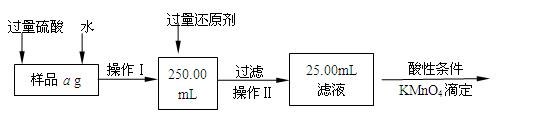
(1)溶解样品改用了硫酸,而不用盐酸,为什么
(2)选择的还原剂是否能用铁(填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 平衡常数 |
Ka=1.8×10-5 |
Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3; PH由小到大的排列顺序是___________________________
(2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
| A.c(H+) | B.c(H+)/ c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/ c(H+) |
E. c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mlPH=2的CH3COOH与一元酸HX,加水稀释过程中PH与溶液体积的关系如图所示,则HX的电离平衡常数_________CH3COOH的电离平衡常数(填大于小于或等于)理由是______________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得PH=6,则溶液中C(CH3COO-)—c(Na+)=____________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=__________
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
e |
I |
| 原子核数 |
单核 |
两核 |
四核 |
| 粒子的电荷数 |
一个单位正电荷 |
一个单位负电荷 |
0 |
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M____________________________________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是________________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+,,这说明维生素C具有(填“氧化性”或“还原性”)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应为:S+2KNO3 +3C=K2S+N2↑+3CO2↑.该反应中还原剂是,氧化剂是。
+3C=K2S+N2↑+3CO2↑.该反应中还原剂是,氧化剂是。
有一包粉末状固体,可能是由Al2(SO4)3、CuCl2、KNO3、Na2O中的一种或几种组成的。为了探究它的成分,某学习小组做了如下实验。
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A。
②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观察到先有沉淀出现,而后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部分蓝色沉淀。
③再取A溶液两份,一份滴加BaCl2溶液后,出现白色沉淀;另一份滴加硝酸银溶液后也出现白色沉淀。请回答下列问题:
(1)原白色粉末一定含有 ,一定不含,可能含有。(填化学式)
,一定不含,可能含有。(填化学式)
(2)写出过程②中涉及到的离子方程式: 。
。
(3)如果要进一步确定可能存在的物质,进行的实验操作及实验现象和结论是
。