某温度下,浓度都是1 mol·L—1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4 mol·L—1,c(Y2)=0.6 mol·L—1,
c(Z2)=0.4 mol·L—1,则该反应的化学方程式可表示为
A.2X2+3Y2 2X2 Y3 2X2 Y3 |
B.3X2+2Y2 2X3 Y2 2X3 Y2 |
C.X2+2Y2 2XY2 2XY2 |
D.2X2+Y2 2X2 Y 2X2 Y |
.把V L含有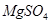 和
和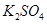 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. 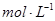 |
B. 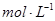 |
C.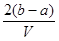 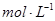 |
D.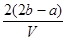 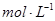 |
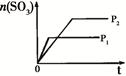
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是()
| A.1mol/L | B.2mol/L | C.3mol/L | D.4mol/L |
下列研究目的和示意图相符的是( )
| A |
B |
C |
D |
|
| 研 究 目 的 |
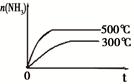
固定容积的密闭容器中,压强对反应: 2SO2(g)+O2(g) 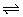 2SO3(g)的影响 2SO3(g)的影响 |
固定容积的密闭容器中,温度对反应: N2(g) +3H2(g) 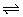 2NH3(g) ΔH< 0的影响 2NH3(g) ΔH< 0的影响 |
固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: CO(g)+H2O(g) 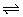 CO2(g)+H2(g)的影响 CO2(g)+H2(g)的影响 |
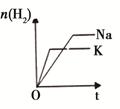
等质量Na、K 分别与足量水反应 |
| 示 意 图 |
 |
 |
 |
 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2 (SO4 )3、 Na2 SO4、 KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为
| A.3:2:3 | B.3:1:2 | C.2:6:3 | D.1:1:1 |