某同学为了使反应2HCl+2Ag=2AgCl+H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是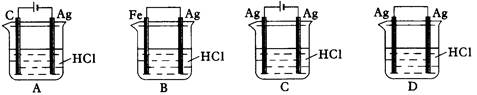
25℃时,浓度均为0.1 moI·L-l的HA溶液和BOH溶液,pH分别是l和11。下列说法正确的是()
| A.BOH溶于水,其电离方程式是BOH=B++OH- |
B.若 一定量的上述两溶液混合后pH=7,则c(A-)=c(B+) 一定量的上述两溶液混合后pH=7,则c(A-)=c(B+) |
| C.在0.1 mol·L-lBA溶液中,c(B+)>c(A-)> c(OH-)>c(H+) |
| D.若将0.1mol·L-lBOH溶液稀释至0.001mol·L-1,则溶液的pH=9 |
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列 有关说法正确的是()
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N 2+===M2++N
2+===M2++N
②P+2H2O(冷)===P(OH)2+H2↑
③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑
判断它们的还原性由强到弱的顺序是 ( )
| A.M、N、P、E | B.P、M、N、E |
| C.M、N、E、P | D.E、P、M、N |
在100mL含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于()
| A.0.25 mol·L-1 | B.0.002 mol·L-1 | C.0.2 mol·L-1 | D.0.02 mol·L-1 |
某试管中盛装的是红棕色气体(可能是两种气体的混合物),当倒扣在盛水的水槽中时,试管内水面上升,但不能充满试管。当试管内鼓入氧气后,可以观察到试管中水柱继续上升,经多次重复后,试管内完全被水充满,则原来试管中盛装的气体是()
| A.一定是O2与NO2的混合气体 | B.可能是NO和NO2的混合气体 |
C.可能是N2与NO2的混合气体 |
D.只可能是NO2一种气体 |