下列溶液中微粒的物质的量浓度关系正确的是
| A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1 mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C.Na2CO3溶液: c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液: |
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
下列化学反应,能用离子方程式H++OH-= H2O来表示的是()
| A.盐酸和氢氧化铜 | B.硫酸和氢氧化钠溶液 |
| C.醋酸和氢氧化钡溶液 | D.稀硝酸和氨水混合 |
标准状况下将 aL HCl气体溶于bmL水中,得到的盐酸溶液密度为c g·cm-3,则该溶液中溶质的物质的量的浓度可表示为( )
A.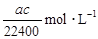 |
B.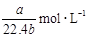 |
C.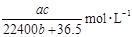   |
D.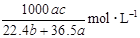 |
某无色透明酸性溶液中,能大量共存的离子组是()
| A.Na+、CO32-、Cu2+、SO42- | B.K+、Fe3+、SO42-、OH- |
| C.Ca2+、NO3-、Cl-、K+ | D.Ba2+、K+、MnO4 -、NO-3 |
下列是某同学对NaHSO4的物质类型进行的分析,其中不正确的是()
| A.根据元素组成可判断是化合物 |
| B.因它电离会生成钠离子又符合盐的组成,故可属于钠盐 |
| C.因它电离会生成硫酸根离子又符合盐的组成,故可属于硫酸盐 |
| D. NaHSO4溶于水可电离出氢离子故可以称为酸 |
下列电离方程式书写错误的是()
| A.H2SO4= 2H+ + SO42- | B.Ba(OH)2= Ba2+ + 2OH- |
| C.Na2CO3 =2Na+1 + CO3-2 | D.NaHCO3= Na+ +HCO3- |