已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是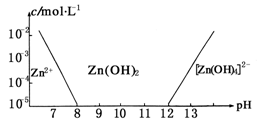
| A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为: Zn2++4OH-=[Zn(OH)4]2- |
| B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17 |
| C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12 |
| D.向1 L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2 mol |
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g)△H1 C(s)+1/2O2(g)="==CO" (g)△H2
②S(s)+O2(g)===SO2(g)△H1 S(g)+O2(g)===SO2 (g)△H2
③H2(g)+1/2O2(g)===H2O(l)△H1 2H2(g)+O2(g)===2H2O (l)△H2
④CaCO3(s)===CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)===Ca(OH)2 (s)△H2
| A.① | B.②③④ | C.④ | D.①② |
已知:H2(g)+F2(g) =2HF(g)△H=-270 kJ· mol-1,下列说法正确的是
| A.氟化氢气体分解生成氢气与氟气的反应是放热反应 |
| B.1 mol氢气与1 mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2molHF气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
已知在1×105 Pa,298 K条件下,2g氢气燃烧生成水蒸气放出242 kJ热量,下列热化学方程式正确的是
| A.2H2 ( g ) + O2 ( g ) = 2H2O ( l )△H = -484kJ/mol |
| B.H2 ( g ) + 1/2O2 ( g ) = H2O ( g )△H = +242kJ/mol |
| C.2H2+ O2 ="==" 2H2O△H = -484kJ/mol |
| D.H2O ( g ) = H2 ( g ) + 1/2O2 ( g )△H = +242kJ/mol |
右图曲线a表示放热反应 X(g)+Y(g)  Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
已知:4NH3 (g)+5O2 (g)="==" 4NO(g)+6H2O(g) ,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)(mol/(L·min)表示,则正确的关系是
| A.4/5υ(NH3)="=" υ(O2) | B.5/6 υ(O2)="=" υ(H2O) |
| C.2/3υ(NH3)="=" υ(H2O) | D.4/5υ(O2)="=" υ( NO) |