下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+1/2O2(g)="==CO" (g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2 (g) △H2
③H2(g)+1/2O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O (l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2 (s) △H2
| A.① | B.②③④ | C.④ | D.①② |
在由硫酸钾、硫酸铁和硫酸组成的混合溶液中,C(H+)=0.1mol/L,C(Fe3+)=0.3mol/L,C(SO42-)=0.6mol/L,则C(K+)为()
| A.0.1mol/L | B.0.2mol/L | C.0.3mol/L | D.0.4mol/L |
如图所示,下列实验操作与方法正确的是()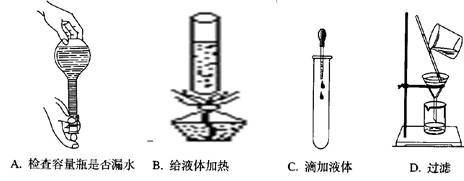
溶液、胶体和浊液这三种分散系的本质区别是( )。
| A.是否有丁达尔现象 | B.是否能通过滤纸 |
| C.分散质粒子的大小 | D.是否均一、透明、稳定 |
下列说法中正确的是()
| A.O2的摩尔质量为32g |
| B.22.4L CO和H2的混合气体所含分子数为NA |
| C.0.1molN2和O2的混合气体在标准状况下的体积为2.24L |
| D.若1molCl2所占体积为22.4L,则其所处状况一定为标准状况 |
相同体积的Na2SO4溶液(浓度为c1)和Al2(SO4)3溶液(浓度为c2),若其中SO42-的物质的量浓度相同,则c1和c2的关系是()
| A.c1=c2 | B.c1=3 c2 | C.c2=3 c1 | D.无法确定 |