T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
(1)容器中发生的反应可表示为______ ________ ________ __
(2)反应进行的前3 min内,用X表示的反应速率 v(X)=____________mol/(L·min)
(3)保持其他条件不变,升高温度,该反应的化学平衡将向________方向移动(填“正反应”或“逆反应”)
(4)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
| A |
|||||||||||||||||
| W |
T |
M |
|||||||||||||||
| B |
D |
Z |
J |
L |
U |
V |
R |
||||||||||
| X |
E |
Y |
G |
Q |
|||||||||||||
(1)化学性质最不活泼的单质是 ,金属氢氧化物中碱性最强的是,
属于过渡元素的是 (填字母),J在周期表中的位置。
(2)A 分别和L、M、T形成的化合物稳定性强弱顺序 > > ,
L、U、V的最高价氧化物对应水化物的酸性强弱顺序 > > 。
(3)V、Q形成的简单阴离子还原性强弱顺序 > ,
D、M、U、V形成的简单离子半径大小顺序 > > > 。
(4)写出Z、B分别形成的最高价氧化物对应水化物相互反应的离子方程式:
。
(5)已知G为常见的红色金属单质,现取7.68g G和50 mL 的浓硝酸反应,当G反应完毕时,溶液体积基本不变,共收集到气体的体积是3.36 L(标准状况,不考虑N2O4),剩余溶液中c(H+)=" 2.2" mol/L,则原硝酸溶液的浓度为。
下图是一些常见单质、化合物之间的转化关系图。有些反应中的部分物质及反应条件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,且E为红棕色的气体。I和K的组成元素相同,I在常温下是无色有毒气体,
J是红棕色固体,G是目前用量最多、用途最广的金属单质。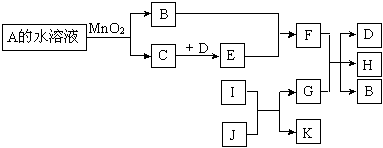
(1)A的化学式是。
(2)K的电子式是。
(3)请写出E和B反应的化学方程式。
(4)请写出G和足量的F稀溶液反应的离子方程式。
(5)常温下G(填“能”或“不能”)溶解于浓的F溶液中,原因是。
化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL)(标准状况) |
50 |
120 |
232 |
288 |
310 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小,
原因是。
②哪一时间段的反应速率最大,原因是。
③求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率。
(设溶液体积不变)
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是:
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为:。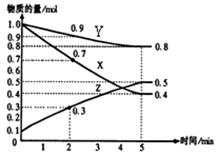
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知:0.8 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出513.2 kJ的热量。
(1) 反应的热化学方程式为
(2) 已知:H2O(1)=H2O(g)△H=" +44" kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是;
(3) 此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(14分)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题: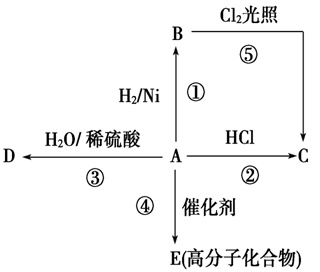
(1)写出A、D、E的结构简式:
A________________,D________________,E________________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
②____________________________,反应类型________。
⑤____________________________,反应类型________。