25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减小的反应 | D.熵增效应大于能量效应 |
用价电子对互斥理论预测H2S和BF3的空间构型,两个结论都正确的是( )
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
根据下表所列电离能I/kJ·mol-1的数据,下列判断中错误的是( )
| A.元素X和Y可能是同周期元素 |
| B.元素X不可能是ⅡA族元素 |
| C.元素X与氯形成化合物时,化学式可能是XCl |
| D.元素Y在化学性质上与锡相似 |
25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是()
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是()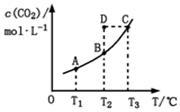
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的 ΔH>0 CO2(g)+H2(g)的 ΔH>0 |
| B.在T2时,若反应处于状态D,则一定有ν正<ν逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |