请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是 。
②纯碱溶液呈碱性的原因是(用离子方程式表示) 。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式: 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为 。
水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为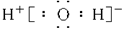 |
| B.4 ℃时,水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273 K、101 kPa,2.4L水所含分子数约为6.02×1023 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.84gNaHCO3晶体中含有NA个CO32- |
| B.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA |
| C.标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA |
| D.理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为NA |
铁氧磁体法处理 的废水的原理可概述为:向
的废水的原理可概述为:向 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol 的废水至少需要加人amol FeSO4·7H2O。下列结论正确的是()
的废水至少需要加人amol FeSO4·7H2O。下列结论正确的是()
| A.x= 0.5 , a= 8 | B.x = 0.5 , a=10 | C.x = 1.5 , a= 8 | D.x = 1.5 , a= 10 |
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,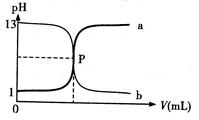
下列叙述正确的是()
A.盐酸的物质的量浓度为 1 mol/L |
B.P 点时反应恰好完全中和,溶液呈中性 |
| C.曲线 a 是盐酸滴定氢氧化钠的滴定曲线 | |
| D.酚酞不能用做本实验的指示剂 |
Al、Fe、Cu 都是重要的金属元素。下列说法正确的是()
| A.三种金属单质在常温下均可溶于浓硫酸 |
| B.三种金属单质放置在空气中均只能生成氧化物 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al. |
| D.制备AlCl3、FeCl3、CuCl2三种固体物质,均不能采用将溶液直接蒸干的方法 |