对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是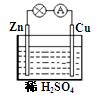
| A.Zn是负极 | B.电子由Zn经外电路流向Cu |
| C.溶液中H+ 向负极移动 | D.Zn电极反应:Zn -2e-==Zn2+ |
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
下列说法不正确的是( )
| A.同族元素在性质上的相似性,取决于原子价电子排布的相似性 |
| B.电离能越小,表示气态时该原子越易失去电子 |
| C.元素的电负性越大,表示其原子在化合物中吸引电子能力越强 |
| D.电负性大的元素易呈现正价,电负性小的元素易呈现负价 |
元素在周期表中的位置,反映了元素的原子结构与元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层电子都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
| A.两种原子的电子层上全部都是s电子 |
| B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子 |
| C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 |
| D.原子核外的M层上的s能级和p能级都填满了电子和d轨道上尚未排有电子的原子 |