下列说法正确的是
| A.化学反应中的能量变化都表现为热量的变化 |
| B.吸热反应在不加热的条件一定不能发生 |
| C.需要加热才能发生的反应一定是吸热反应,放热反应在常温下一定很容易发生 |
| D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小 |
19世纪俄国化学家门捷列夫的突出贡献是( )
| A.提出了原子学说 | B.发现了元素周期律 |
| C.发现了稀有气体 | D.提出了分子学说 |
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g) 2NH3(g) ⊿H=-92.4kJ·mol-1]
2NH3(g) ⊿H=-92.4kJ·mol-1]
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molN2、3molH2 |
2molNH3 |
4molNH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3<1
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,t表示温度,n表示物质的量):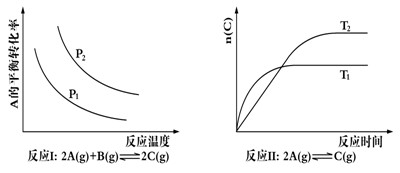
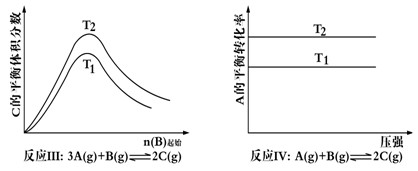
根据以上规律判断,下列结论正确的是
| A.反应Ⅰ△H> 0,P2>P1 | B.反应Ⅱ△H<0,T1>T2 |
| C.反应Ⅲ△H> 0,T2>T1;或△H<0,T2<T1 | D.反应Ⅳ△H<0,T2>T1 |
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是
| A.阴极自始至终只析出氢气 | B.阳极先析出Cl2,后析出O2 |
| C.电解的最后阶段为电解水 | D.溶液pH不断增大,最后pH=7 |
下列说法正确的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的△H>0,△S>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |