(1)下图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是 _ (填代号)。
①亚硫酸钠和硫酸②二氧化锰和浓盐酸③浓氨水和生石灰④石灰石和稀硫酸⑤锌和稀硫酸⑥硫化亚铁与稀硫酸⑦双氧水和二氧化锰
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是_______(填代号)。
| A.氢氧化钠溶液 | B.甲基橙溶液 | C.稀盐酸 | D.澄清石灰水 |
②除上述方法外,你认为是否还有其它的方法,具体如何操作_______。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是 ,其理由是
。
②以下是除去SO42-的实验方案。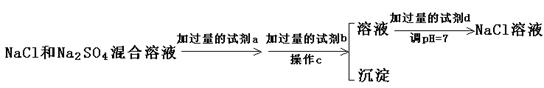
过量的a试剂是 ,C操作中所使用的玻璃仪器的名称是 ,证明SO42-已经沉淀完全的方法是  。
。
下图中A、B、C是常见的化学实验装置,请回答下列问题:
(1)实验里用A装置加热制取氯气,为得到纯净干燥的氯气,可让A中出来的气体在进入收集装置前依次分别通过装有和的两个洗气瓶B,作用是分别除去氯气中的杂质和, 尾气应通入溶液,作用是,反应的化学方程式为,
(2)若C装置中圆底烧瓶a里充满了纯净、干燥的HCl气体,b、c为滴有石蕊试液的水,则引发水上喷的操作是,该实验的原理是。
(3)如果只提供如图D的装置,进行HCl的喷泉实验,请说明引发喷泉的方法:。
(4)若C装置中圆底烧瓶里充满了纯净、干燥的氯气,现用该装置做喷泉实验,则b、c中应盛的液体为(写物质的名称)
下图是实验室常用的实验仪器及实验装置图,请据图回答:
(1)写出上图中序号①~④仪器的名称:②; ③;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 ;(填仪器序号)
(3)若向II装置中加入碘水和少量CCl4,振荡后静置,会观察到什么现象?;静置后,再将液体分离的操作是_______________________________;
(4)装置I中冷凝水由(填a或b)口通入,温度计水银球的位置是;
(5)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.结晶法 | D.分液法 E.渗析法 F.蒸馏法 G.过滤法 |
①___________分离饱和食盐水和沙子的混合物;
②___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
③___________分离水和煤油的混合物;
④___________分离水和酒精。
下图是实验室中制备气体或验证气体性质的装置图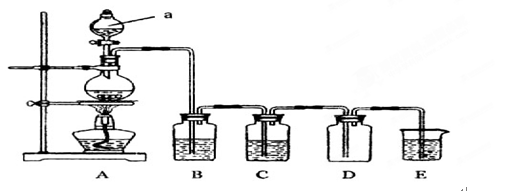
(1)写出用A制取氯气的化学方程式______________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+则装置B中的溶液的作用是___________________________________;装置D中加的最佳试剂是(填序号)___________。
a.浓H2SO4b.FeCl2溶液 c.KSCN与FeCl2的混合溶液d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________。
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为: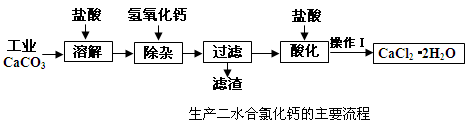
(1)CaCO3与盐酸反应的离子方程式。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:①,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括、、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操作 |
现象 |
通入氯气至过量 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是。
(2)A中溶液变红的原因是。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为 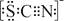 。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是。
③通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是mol。