镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是( )
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是( )
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
在通常条件下,下列各组物质的性质排列正确的是
| A.酸性:H2SO4﹥H3PO4﹥HClO4 |
| B.水溶性:HCl﹥SO2﹥NH3 |
| C.沸点:乙烷﹥戊烷﹥丁烷 |
| D.氧化性:Cl2﹥Br2﹥I2 |
下列对营养物质在人体内发生的变化及其对人的生命活动所起的作用的叙述不正确是
A.淀粉 葡萄糖 葡萄糖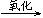 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.纤维素 葡萄糖 葡萄糖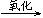 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
C.油脂 甘油和高级脂肪酸 甘油和高级脂肪酸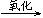 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质 氨基酸 氨基酸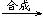 人体所需的蛋白质(人体生长发育、新陈代谢) 人体所需的蛋白质(人体生长发育、新陈代谢) |
CH2 = CHCH2OH可能发生的反应类型有:①加成反应②氧化反应③酯化反应④中和反应
| A.只有①③ | B.只有①②③ | C.只有①③④ | D.只有①② |
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是
| A.R一定是共价化合物 |
| B.R一定是离子化合物 |
| C.R可能是共价化合物,也可能是离子化合物 |
| D.R不可能是气态物质,只可能是固态物质 |
有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是
| A.甲>乙>丙>丁 | B.丙>丁>乙>甲 |
| C.丙>丁>甲>乙 | D.丁>乙>甲>丙 |