一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。
第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称量,生成沉淀为5g。
⑴若该瓶试剂中的Na2CO3的质量分数为A,则氢氧化钠的质量分数 (填大于、等于或小于),原因是 。
⑵计算该20g试剂中含有杂质Na2CO3的质量分数(结果精确到0.1%)。
石灰石是常用的建筑材料。
①甲乙同学设计了如下实验方案进行探究:
Ⅰ.甲同学取石灰石按图所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,由此甲同学认为石灰石已分解。甲同学结论不合理的理由是 。
写出石灰水变浑浊的化学方程式 。
Ⅱ.乙同学进行如下实验,完成下表
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量煅烧后固体于试管中,加水振荡,过滤,取滤液,滴加 溶液 |
溶液变红 |
证明固体中 含有 |
| 取滤渣滴加足量的稀盐酸 |
|
含有碳酸钙 |
②为了测定石灰石中碳酸钙的质量分数(假设杂质不参加反应),乙同学设计称取石灰石样品100g,高温煅烧至质量不再改变。实验中固体的质量变化如下:
Ⅰ.生成二氧化碳的质量是 g。
Ⅱ.求石灰石中碳酸钙的质量分数。(根据化学方程式列式计算)
M g某石灰石样品与足量稀盐酸反应(杂质不反应),共生成0.1mol二氧化碳。请计算:
① 参加反应的碳酸钙的质量。(请根据化学方程式列式计算)
② 已知该样品中含碳酸钙80%,则M= g。
鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,某同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10克放在烧杯里,然后往烧杯中加入足量的稀盐酸90克,充分反应后,称得反应剩余物为97.14克(假设鸡蛋壳中的其它物质不与稀盐酸反应)。请计算:
(1)产生二氧化碳气体多少克。
(2)计算该鸡蛋壳中碳酸钙的质量分数。
已知碳酸氢铵的化学式为NH4HCO3,计算:
(1)碳酸氢铵的相对分子质量 .
(2)碳酸氢铵中各元素的质量比 .
(3)158gNH4HCO3中含氮多少克 .
计算题:某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状;
②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如下图所示: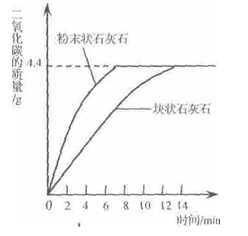
请回答:每份样品充分反应后.生成二氧化碳的质量为 g;该样品中碳酸钙的质量分数为多少呢