碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g)  WI2(g)ΔH<0
WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为 ▲ 。
(2)能够说明上述反应已经达到平衡状态的有 ▲ 。
| A.I2与WI2的浓度相等 |
| B.容器内气体压强不再变化 |
| C.W的质量不再变化 |
| D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等 |
E.容器内混合气体的密度保持不变
(3)下图为该反应在450℃时的时间—速率图,则t2时刻改变的外界条件可能是 ▲ ,若t4时刻将容器压缩至一半(各物质状态不变),保持该条件至t6,请在图中画出t4到t6时间段内大致曲线图,并在相应曲线上标上υ3(正)、υ3(逆)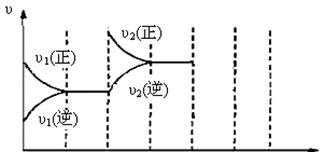
t0 t1 t2 t3 t4 t5 t6 t
(4)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因 ▲ 。
有关SO2说法错误的是
| A.单质硫在空气中燃烧可生成SO2 |
| B.SO2能使品红溶液褪色是因为它具漂白性,加热可恢复原本红色 |
| C.SO2和Cl2都具有漂白作用,所以将两种气体等物质的量同时作用于潮湿有色物,可增强漂白作用 |
| D.SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列有关说法正确的是
| A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.步骤④的作用是达到富集溴的目的 |
| C.过程②中MgCl2·6H2O加热脱水制得无水MgCl2 |
| D.工业上电解熔融精盐的过程称为氯碱工业 |
某恒温密闭容器中,可逆反应A(s) B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,v(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是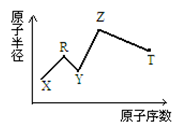
| A.原子半径和离子半径均满足:Y < Z |
| B.氢化物的沸点排序 :Y > T > R |
| C.最高价氧化物对应的水化物的酸性 :T < R |
| D.由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
在55℃时,下列说法正确的是
| A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 |
| B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L |
| C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO) |
| D.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)> c(NH4+) > c(H+) > c(OH-) |