如图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3。)图中⑤表示的物质是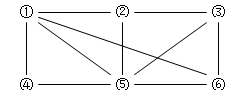
| A.Al或Fe2O3 | B.NaOH溶液 |
| C.氢碘酸 | D.NH3或O2 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是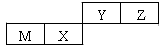
| A.原子半径Z > Y |
| B.X 的最简单气态氢化物的热稳定性比Z的小 |
| C.Y的最高价氧化物对应水化物的酸性比X 的弱 |
| D.M的最高价氧化物对应水化物不能与NaOH溶液反应 |
除去下列物质中的杂质选用的试剂和方法最合理的是
| 物质 |
杂质 |
试剂 |
方法 |
|
| A |
甲烷 |
乙烯 |
酸性高锰酸钾溶液 |
洗气 |
| B |
氯化亚铁溶液 |
氯化铁 |
过量铁粉 |
过滤 |
| C |
二氧化硅 |
氧化铝 |
氢氧化钠溶液 |
过滤 |
| D |
乙酸乙酯 |
乙酸 |
饱和碳酸钠溶液 |
蒸馏 |
下列说法正确的是
| A.蛋白质及其水解产物都具有两性 |
| B.淀粉和油脂都是可水解的高分子化合物 |
| C.鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
下列叙述中正确的是
| A.图①中正极附近溶液pH降低 |
| B.图①中电子由Zn流向Cu,盐桥中的Cl—移向CuSO4溶液 |
C.图②正极反应是O2+2H2O+4e¯ 4OH¯ 4OH¯ |
| D.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
下列解释实验事实的方程式正确的是
A.氨水中滴入酚酞溶液,溶液变红: NH3·H2O  NH4+ + OH— NH4+ + OH— |
B.90℃时,测得纯水中c(H+)·c(OH—) =3.8×10—13: H2O(l)  H+(aq) + OH—(aq) H+(aq) + OH—(aq) H<0 H<0 |
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+ 2Fe2+ + SO42—+ 4H+ |
| D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O →2C6H5OH+Na2CO3 |