(10分)某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0 g铝片放入圆底烧瓶中,然后通过分液漏斗加入500 mL 0.5 mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示) ,请你帮助该小组同学回答下列问题: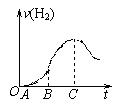
(1)曲线OA段不产生氢气的原因是_____________ _ ______
____________________ _____,
有关的离子反应方程式为_________________________ _____ _____
(2)曲线BC段产生氢气的速率突然加快的主要原因是
____________________________________________________________________________
(3)点C以后产生氢气的速率逐渐减小的主要原因是
____________________________________________________________________________
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)___________
在830K时,下列反应的平衡体系具有某些特殊性:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
①若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=0.75mol·L-1,达到平衡后CO的转化率为20%
②若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=4.5mol·L-1,达到平衡后CO的转化率为60%
设830K时,以起始浓度分别以c(CO)=a mol·L-1,c(H2O)=b mol·L-1投料,发生以上反应,测得平衡后c(H2)=c mol·L-1.
请注意上述数据,总结出其中规律,填写以下空白。
(1)选择填空:在多次试验中,若保持b不变而减小a,则达到平衡时CO的转化率________ 水蒸气的转化率________.
| A.增大 | B.减小 | C.不变 | D.无法确定 |
(2)当a=4,c=1.5时,b=______________.
(3)当a=2b时,a∶c=______________.
(4)a、b、c在该平衡中的关系式是__________________.
在密闭容器中,N2、H2起始的物质的量分别为10mol、30mol,达到平衡时N2的转化率为25%,若反应从NH3的分解开始,在相同条件下欲使平衡时各成分百分含量相同,则应加入氨的物质的量为__________,氨的转化率为__________。
在体积为VL的密闭容器中,充入a molN2和b molH2,经3分钟生成c molNH3。
(1)v(N2)应表示为_______________(2)H2的转化率为_______________
(3)NH3的体积分数为_____________(4)反应前后的压强比为____________
CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为CuCl2的水溶液中存在如下平衡: [CuCl2(H2O)4]2+ + 4Cl- [CuCl4]2- + 4H2O。
[CuCl4]2- + 4H2O。
蓝色 黄色
现欲使溶液由黄色变为绿色或蓝色,请写出两种可采用的方法。
通过实验测定反应速率的方法有多种,如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的____________来实现;在KMnO4与H2C2O4反应中,可通过测定____________________________来测定该反应的速率;在Na2S2O3和H2SO4反应中,该反应的速率可通过__________________________来测定。写出KMnO4与H2C2O4反应的离子方程式:。