17.(共6分)金属Na、Mg、Al有广泛的应用。
(1)周期表中Na、Mg、Al所在周期是 。
(2)为比较Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢。
实验2:各取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
已知:元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断。
由实验1和实验2得出的结论是 ,用原子结构理论解释:同周期元素从左到右, 。
(3)Na、Mg、Al都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是 。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是 。
在密闭容器中加入2molA和1molB发生反应2A(g)+B(g)  3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,以下配比作为起始物质: ① 4mol A+2mol B ② 2mol A+1mol B+3mol C+1mol D
3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,以下配比作为起始物质: ① 4mol A+2mol B ② 2mol A+1mol B+3mol C+1mol D
③ 3mol C+1mol D ④ 1mol A+0.5mol B+1.5mol C+0.5mol D
⑤ 3mol A+1mol B
(1)达平衡后,C的体积分数仍为ω的是________________。
(2)达平衡后,C的体积分数小于ω的是________________。
(3)若发生的反应为2A(s)+B(g)  3C(g)+D(g),即A的状态,由气态改为固态,
3C(g)+D(g),即A的状态,由气态改为固态,
其他条件不变,则C的体积分数为ω的是__ ______________。
______________。
(4) 若将题 中“保持体积和温度不变”改为“保持压强和温度不变”,则C的体积分数为ω的是___________。
中“保持体积和温度不变”改为“保持压强和温度不变”,则C的体积分数为ω的是___________。
(12分)利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高
温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数 值为
值为
57.3 kJ/mol):_______________________________________________。
(2)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
现有下列物质:
①NaCl晶体②液态SO2③纯醋酸④硫酸钡 ⑤铜 ⑥酒精⑦熔化的KCl⑧NaOH溶液,请用以上物质回答下列问题。(填序号)
(1)属于强电解质且在上述状态下能导电的是;  (2)属于弱电解质的是;
(2)属于弱电解质的是;
(3)属于非电解质,但溶于水后的水溶液能导电的是。
(14分,每空2分) I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2 (g)
(g)  2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是 _______(填序号,错选扣分)。
① 升高温度② 增大压强③ 使用催化剂④ 及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g) 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,
说明该反应已经达到化学平衡状态____________________________________。
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________________(选填序号)。
| 选项 |
a |
b |
c |
d |
| x |
温度 |
温度 |
加入H2的物质的量 |
加入NH3的物质的量 |
| y |
NH3的物质的量 |
平衡常数K |
NH3的转化率 |
生成物物质的量总和 |
II.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
--------- |
| 实验2 |
5 |
5 |
40 |
25 |
---------- |
| 实验3 |
5 |
5 |
V2 |
0 |
----------- |
该实验的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反应C(s)+H2O(g)  H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率 与时间t的关系如右图。
与时间t的关系如右图。
①图中t4到t6段时引起平衡移动的条件可能是 ;
;
②图中表示平衡混合物中CO的含量最高的一段时间是。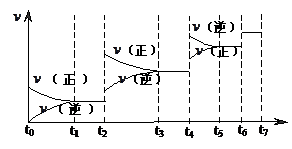
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5 L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密 闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)
闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。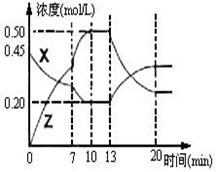
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是 __(填序号)
__(填序号)
①增加Z的量②增加X的量③升温
④降温⑤使用催化剂