已知: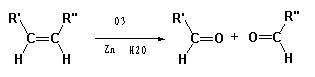
某一元氯代烃A分子式为C6H11Cl,可以发生如下图所示的转化: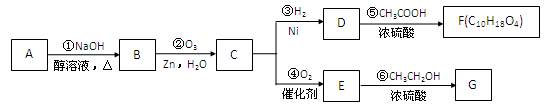 结构分析表明F分子中含有两个甲基。请回答下列问题:
结构分析表明F分子中含有两个甲基。请回答下列问题:
(1)G的分子式为_____________。
(2)写结构简式:A________________________,E_____________________。
(3)A→B的反应方程式是____________________________________________。
D→F的反应方程式是____________________________________________。
(4)F 和 G____________(是或否)互称为同分异构体。
(14分)短周期元素W、X、Y、Z,其有关性质或结构信息如表所示。
| 元素 |
W |
X |
Y |
Z |
| 有关性质或结构信息 |
能形成+7价的化合物 |
基态原子核外s能级上的电子数是P能级上电子数的2倍 |
该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 |
通常情况下能形成同周期中最稳定的双原子分子 |
(1)X位于元素周期表中第________周期第_______族,元素X和元素Y相比,电负性较小的是_______ (写元索名称)。化合物XY2晶体与X的单质晶体属_______ (填同一类型或不同类型)。
(2)写出元素Y的含有10个中子的一种核素符号_______,X的一种氢化物X2H2分子中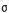 键与
键与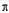 键的数目之比为_______。
键的数目之比为_______。
(3)Y与Z可以组成多种形式的化合物.其中Z2Y5能与水反应生成物质A。写出物质A的稀溶液与过量的Fe反应的离子方程式:____________________________。
(4)W的最髙价氧化物为无色液体,9.15g该物质与足量的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为______________。
如图所示为中学化学实验中几种常见仪器的部分结构:
(1)请写出上述仪器的名称:
A ;B ;C 。
(2)若要配制一定物质的量浓度的硫酸溶液,必须使用上述仪器中的 (填字母)。
(3)上述仪器在使用之前必须检查是否漏水的是 (填字母),检查该仪器是否漏水的具体操作方法是 。
(12分)实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液80 mL,回答下列问题:
(1)本实验需称量碳酸钠晶体(Na2CO3·10H2O)的质量为 g。
(2)应选用 mL容量瓶。
(3)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后,直接倒入经检查不漏水的容量瓶中,洗涤烧杯和玻璃棒各2~3次,洗涤液也移至容量瓶中,然后加水至距刻度线1~2 cm处,用胶头滴管加蒸馏水至刻度线,然后将溶液转入试剂瓶中。指出上述操作中的3个错误。
① ;
② ;
③ 。
(4)配制上述溶液,造成所配溶液浓度偏低的原因是 。
| A.称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中 |
| B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 |
| C.定容时俯视刻度线 |
| D.洗涤液移至容量瓶中时洒出一部分 |
【化学——选修5:有机化学基础】某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):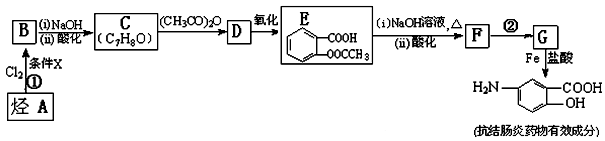
根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
| A.水溶性比苯酚好,密度比苯酚的大 | B.能发生消去反应 |
| C.能发生聚合反应 | D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出符合下列条件的E的同分异构体的结构简式(任写三种): 。
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知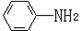 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物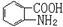 的合成路线 (仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)。
的合成路线 (仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)。
【化学——选修3:物质结构与性质】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大。A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族。回答下列问题:
(1)A、B、C第一电离能由大到小的顺序为: (用元素符号表示)。
(2)B与C形成的二元化合物中,属于非极性分子的是: (填化学式);该分子中心原子的杂化类型为: 。
(3)A、C元素形成的常见含氧酸中,分子的中心原子的价层电子对数为4的酸是 ;(填化学式,下同)酸根呈平面三角形的酸是 。
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为 ;F的配位数为 。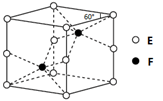
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为: ;n值为 ;Dn+的基态电子排布式为: 。