(12分)实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液80 mL,回答下列问题:
(1)本实验需称量碳酸钠晶体(Na2CO3·10H2O)的质量为 g。
(2)应选用 mL容量瓶。
(3)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后,直接倒入经检查不漏水的容量瓶中,洗涤烧杯和玻璃棒各2~3次,洗涤液也移至容量瓶中,然后加水至距刻度线1~2 cm处,用胶头滴管加蒸馏水至刻度线,然后将溶液转入试剂瓶中。指出上述操作中的3个错误。
① ;
② ;
③ 。
(4)配制上述溶液,造成所配溶液浓度偏低的原因是 。

| A.称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中 |
| B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 |
| C.定容时俯视刻度线 |
| D.洗涤液移至容量瓶中时洒出一部分 |
现有下列短周期元素性质的有关数据: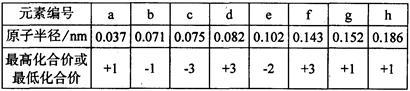
(1)根据元素周期律确定a至h 8种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内。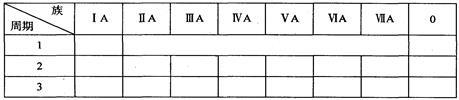
(2)上述元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)_______________。
(3)氢化铝锂(LiAlH4)是一种易燃易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂易水解,最初得三种产物,请写出其水解反应方程式________________。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,请写出这种还原剂的电子式 。写出该物质受热分解的反应方程式:______ _______。
(4)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,写出“白石墨”的最小结构单元--六元环的结构式
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
分Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)===CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),此反应能自发进行的原因是____________________________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________、B电极上生成________。
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
罂粟碱是一种异喹啉型生物碱,其盐酸盐可用于治疗脑血栓、肢端动脉痉挛等。罂粟碱的合成方法如下: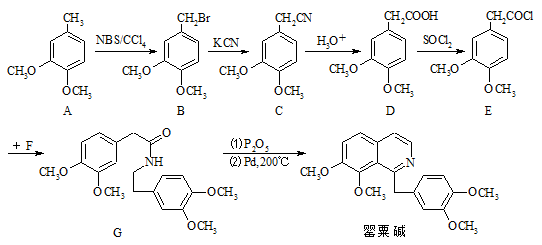
(1)B分子中的官能团有 和 (填名称)。
(2)D→E的转化属于 反应(填反应类型)。
(3)E和F发生取代反应生成G的同时有HCl生成,则F的结构简式是 。
(4)E的同分异构体有多种,写出一种符合下列要求的异构体X的结构简式: 。
Ⅰ.含氧官能团种类与D相同。
Ⅱ.核磁共振氢谱图中有4个吸收峰。
Ⅲ.属于芳香族化合物,苯环上一取代物有两种。
(5) 已知: (R、
(R、 为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备
为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备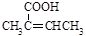 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: