有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷总数为36。Y元素原子最外层电子数占其核外电子总数的3/4,W元素原子最外层电子比同周期Z元素多5个电子,W和Y属于同一主族。
(1)写出元素符号:X______Y_________Z________W___________.
(2)Z、W两元素的最高价氧化物对应水化物反应的离子方程式是__________
下面A~F是几种常见烃的分子球棍模型。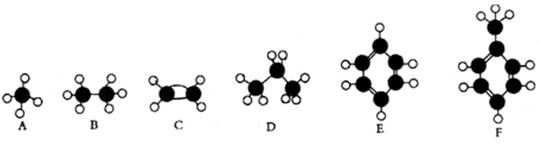
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是。
(2)能够发生加成反应的气态烃是。
(3)一氯代物的同分异构体最多的是。
(4)所有原子均在同一平面上的是。
(5)能使酸性高锰酸钾溶液褪色的是(填对应字母)。
欲分离苯和苯酚,一般可向其混合物中加入稍过量的浓氢氧化钠溶液,反应的离子方程式为。再将该混合物转移到分液漏斗中,振荡,静置后溶液将出现 现象,然后分液。从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是 ;向另一份溶液中加入浓溴水,发生反应的化学方程式是 。从分液漏斗上口倒出的上层液体是 。
【化学——物质结构与性质】
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石< 石墨
d.晶体中共价键的键角:金刚石>石墨
(2)某石蕊的分子结构如图所示。
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是(填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是(填化学式);
②该石蕊易溶解于水,分析可能的原因是;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 Cu NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中
Cu原子的配位数为 
甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 |
实验现象 |
实验依据和结论 |
 3mL1mol/L 3mL3mol/L 盐酸盐酸 (金属质量相同,盐酸均过量) |
均有气体生成,锌粉先消失,锌块后消失 |
因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2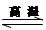 Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题: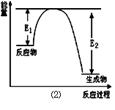
(1)上述反应中的还原剂是,还原产物是。
(2)该反应是(填“吸热”或“放热”)反应。
(3)在一定温度下,上述反应在4L密闭容器内进行,用M、N两种物质描述其物质的量随时间变化的曲线如图⑶所示: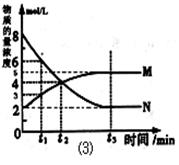
①M、N表示的物质分别为、。
②比较t2时刻,正逆反应速率大小 (正)
(正) (逆)。
(逆)。
(填“>”、“=”、“<”)。.
③若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为。
④t3时刻化学反应达到平衡时反应物的转化率为。
(4)①某种氢燃料电池是用固体金属氧化物陶瓷作电解质,某电极上发生的电极反应为:A极H2-2e-+O2-===H2O;则A极是电池的极 (填“正”或“负”)。
②上述合成氮化硅的反应产生的尾气不能排放,经过处理以后可以用下图所示的仪器测量尾气中CO的含量。多孔电极中间的固体氧化锆—氧化钇为电解质,这种固体电解质允许O2-在其间通过,其工作原理如图⑷所示,其中多孔Pt电极a、b分别是气体CO、O2的载体。
Ⅰ.该电池的正极为(填a或b);O2流向(填 “正极”或“负极”)
Ⅱ.该电池的正极反应式为,负极反应式为。