A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品)。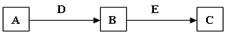
(1)若D为氧气,C为NaAlO2,试写出B转化为C的化学方程式 。
(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性。试写A转化为B的化学方程式 。画出组成单质A的元素原子结构示意图 。
(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,请写出B转化为C的离子方程式 。
(4)若A常温下为固态单质,化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,且D、E为同一物质,则B为 。
(5)若B、D为质子数小于18的元素原子形成的单质,A、E、C均为氧化物,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,请写出A转化为B的化学方程式 。
现有三组混合物:①汽油和水;②碘和四氯化碳;③硫酸钡和稀硫酸。分离以上各混合物的正确方法依次是:、、。
100mL气体A2跟50mL气体B2恰好完全反应生成100mL气体C(体积均在相同状况下测定),则C的化学式为,其推断理由是。
已知A、B、C、D、E是中学化学中常见的五种化合物,它们分别由短周期两种元素组成,甲、乙、丙是单质,常温下甲、丙、A、C、D、E是气体,B为液体,乙为固体,①③必须在高温下反应才能发生。这些单质和化合物之间存在如下关系:
(1)写出甲的分子式; A的结构式;B的电子式。
(2)若反应②是重要的工业反应,则该反应的化学方程式为。
若反应②生成的化合物E具有漂白性,则该反应的化学方程式为。
(3)1mol单质乙和1mol化合物B在高温下反应,生成1mol化合物D和1mol单质丙需吸收131.5kJ热
量,写出其反应的热化学方程式:。
(4)在密闭容器中,反应①是在高温下才能发生的可逆反应,其化学反应方程式为:
;反应达平衡后,若增大体系的压强,该平衡(填向左移动,向右移动,不移动);其理由是:。
将AgCl分别投入下列溶液中:
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点。NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于_________(填编号)。
| A.破坏臭氧层 | B.高温下能使一些金属被氧化 | C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式______________________________________
(3)在常温下,把NO气体压缩到100大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力的2/3?__________________________.
(5)NO成为“臭名昭著的明星分子”所包含的哲学原理是_____________________________