主要元素、、、的原子序数一次增大,的原子最外层电子数是次外层电子数的3倍。、和分属不同的周期,他们的原子序数之和是原子序数的5倍。在由元素、、、组成的所有可能的二组分化合物中,由元素与形成的化合物的熔点最高。请回答下列问题:
(1)元素原子的层电子排布式为,分子的空间构型为;
(2)单质与水发生主要反应的化学方程式为;
(3)化合物的化学式为,其晶体结构与相同,而熔点高于。熔点较高的原因是。将一定量的化合物负载在上可制得/催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,的键角约为;
(4)、、可形成立方晶体结构的化合物,其晶胞中占据所有棱的中心,位于顶角,处于体心位置,则该晶体的组成为︰︰=;
(5)含有元素的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。
工程塑料ABS树脂(结构简式如下)合成时用了三种单体。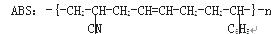
式中- C6H5是苯基。这三种单体的结构简式分别是:
、、
如图为以惰性电极进行电解的串联电解装置图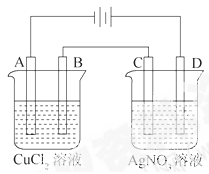
(1)写出A、B、C、D各电极上的电极方程式。
A;
B;
C’
D。
(2)在A、B、C、D各电极上析出生成物的物质的量比为。
指出下列中反应的反应类型。
(1)CH2===CH2+Br2―→CH2BrCH2Br,反应类型:__________。
(2)CH3CH3+2Cl2  CH2ClCH2Cl+2HCl反应类型:________。
CH2ClCH2Cl+2HCl反应类型:________。
(3)C2H4+3O2  2CO2+2H2O,反应类型:___________。
2CO2+2H2O,反应类型:___________。
100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况)。同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和。
计算原混合酸中HNO3的物质的量浓度的取值范围_________________________
H2SO4的物质的量浓度的取值范围_______________________。
已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答: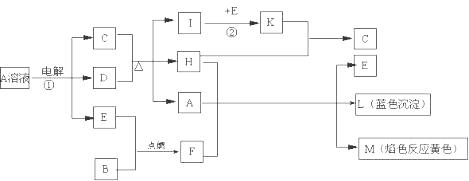
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。