实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品 。
。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_________________________________。
(2)反应中加入过量的乙醇,目的是__________________________________________________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图: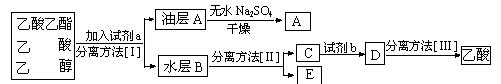
则试剂a是:______,分离方法I是______,分离方法II是______,
试剂b是________,分离方法III是_____________ _。
_。
铁不能与冷、热水反应,但能与水蒸气反应。如下图所示,在装置的硬质玻璃管内放入还原铁粉和石棉绒的混合物,通入水蒸气,加热,就可以完成高温下“Fe与水蒸气反应的实验”。
请回答下列问题:
(1)写出反应的化学方程式:。
(2)实验开始时,应先点燃(填写“酒精灯”或“酒精喷灯”),。
(3)干燥管中盛装的物质可以是(填写一种即可),检验气体A的方法:
。
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验。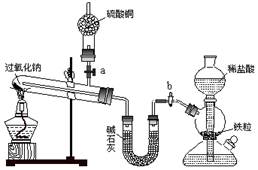
(1)实验前,装置的气密性检验方法是。
(2)该装置中,碱石灰的作用是;实验开始时,先打开a、b产生氢气,一段时间后,再点燃酒精灯加热,目的是。
(3)在启普发生器中,下列做法可以加快生成氢气速率的有。
A.滴加少量的硫酸铜溶液B.铁粒改用相同量的铁粉 C.稀盐酸改为浓度为其2倍的稀硝酸 D.适当加热
(4)若实验过程中观察到淡黄色粉末变成白色,干燥管内硫酸铜变成蓝色。则Na2O2与H2反应的化学方程式为。
(5)实际实验过程中观察到Na2O2熔化后,很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色。则Na2O2与H2反应的化学方程式为。
(6)出于实验安全考虑,实验结束时。
A.应先关闭活塞b,然后移去酒精灯
B.应先移去酒精灯,然后关闭活塞b
C.A和B都可以
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中观察到一些现象,并产生了相关的思考。
(1)向盛KI溶液的试管中滴加氯水,溶液呈棕黄色。如果继续向试管中滴加氯水,充分振荡,溶液逐渐变浅,最后变成无色。写出并配平溶液由棕黄色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)将KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(3)为证明溴单质的氧化性强于Fe3+,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈棕黄色。为了证明棕黄色溶液是由于Fe3+的存在,而不是溴单质颜色所致,应当采取的补充实验是
(4)在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气”或“无法确定”),判断理由是_________________。
(2)写出A装置中反应的化学方程式并标出电子得失情况:_____________。
(3)B装置中盛放的试剂是__________________,其作用是____________。
(4)C装置中观察到的现象是________________。
为探究如何尽可能多的使NO2被水吸收,某活动小组设计并完成了以下实验。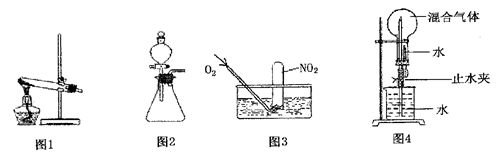
(1)活动小组同学利用铜与浓硝酸反应制取NO2、过氧化氢溶液与MnO2制取O2。
①根据反应原理他们选用了相同的装置(填“图l”或“图2”)分别制取NO2和O2。
②写出铜与浓硝酸反应的离子方程式。
③写出过氧化氢溶液与MnO2制取O2时的化学方程式。
④收集NO2的方法是。
(2)活动小组的同学做了如下准备工作:用气囊收集好纯净的O2,收集了一试管NO2,用干燥的烧瓶收集了一定比例的NO2和O2的混合气体。
①为了尽可能多的使NO2被水吸收,并达到较好的实验效果,利用图3吸收气体时,用气囊通入O2与直接利用制气装置制取并通入O2相比,其优点是:
。
②利用图4吸收气体时,其操作和现象为:
。
③若图4中混合气体NO2和O2全部被吸收时所得溶液物质的量浓度为mol/L(保留两位有效数字)。