(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是_____________; 若实验中不加盖泡沫塑料板,则求得的中和热数值 (填偏大、偏小、无影响)。

(3)实验室用50mL 0.50mol·L-1盐酸、50mL 0.55mol·L-1NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
| A.反应前盐酸的温度 |
| B.反应前盐酸的质量 |
| C.反应前氢氧化钠溶液的温度 |
| D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠溶液 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.4 |
| 2 |
20.2 |
20.4 |
23.6 |
| 3 |
20.5 |
20.6 |
23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯。反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:第一种方法加入几滴KMnO4溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果是上层液体呈紫红色。
在这个实验中:(1)水浴的作用是,浓硫酸的作用是。
(2)水流经冷凝管时,应从口进入。(填a或b)
(3)烧杯中乙酸乙酯在层,根据是,加入几滴KMnO4溶液后,水层不显紫色,是因为。
(4)粗制乙酸乙酯经过提纯,可得到纯净的酯,提纯的操作方法是。
(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。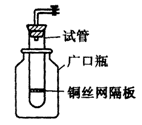
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。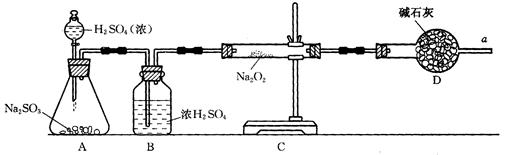
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
| A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧. |
| B.将C装置中反应后的固体物质溶于适量水配成溶液. |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成. |
| D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
C(HCl)/ mol·l-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
块状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
块状 |
0.6 |
20 |
41 |
280 |
| 4 |
粉末 |
0.8 |
20 |
40 |
30 |
| 5 |
块状 |
1.0 |
20 |
40 |
120 |
| 6 |
块状 |
1.0 |
30 |
50 |
40 |
(1)该反应属于反应(填“吸热”或“放热”)。
(2)实验5、6表明对反应速率的影响,说明,反应速率越快。
(3)根据实验1、3、5可以得出条件对反应速率的影响规律是。
(4)从本实验数据中分析,影响化学反应速率的因素还有,能表明这一规律的实验序号是。
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2),并将Cl2依次通入NaBr溶液和KI-淀粉溶液中。如图所示仪器及药品,试回答: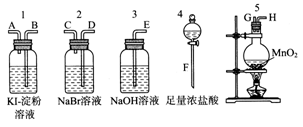
(1)若所制取气体从左向右流向时,上述仪器接口的连接顺序为________接________、________接________、________接________、________接________。(填字母)
(2)实验开始后装置5中反应的离子方程式为______________________________。
(3)装置3的作用是__________________________________,反应的离子方程式为_______________________________。
(4)装置1中产生的现象是:溶液先变蓝一段时间后蓝色褪去,生成两种强酸,请写出蓝色褪去的化学方程式:___________________________________________________。
某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为和;
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有;
(3)他们首先用下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是
(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是;
(5)通过上述探究实验,你能得到的结论是