设NA为阿伏加德罗常数,下列叙述中正确的是
| A.12.4g白磷晶体中含有的P-P键数是0.4NA |
| B.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA |
| C.2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA |
| D.1mol甲醇中含有C—H键的数目为4NA |
下列物质都能导电,其中属于电解质的是 ()
A.熔融的NaOH B.金属铝C.稀硫酸D.NaCl溶液
4、下列说法错误的是()
A.蒸发和蒸馏都是利用了混合物各组分沸点的不同
B.食盐水的蒸发和自来水的蒸馏都能用到的仪器有铁架台、酒精灯、石棉网等
C.分液时,将分液漏斗上口的玻璃塞打开的目的是为了平衡分液漏斗内外的气压,便于液体流下
D.过滤时玻璃棒靠在三层滤纸一边
下列自然、生活中的事例不属于氧化还原反应的是()
| A.动物呼吸 | B.植物光合作用 | C.金属生锈 | D.石膏点制豆腐 |
下列物质的提纯方法可能属于化学变化的是()
| A.蒸馏 | B.过滤 | C.分液 | D.洗气 |
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是()
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
C.25°C时,Mg(OH)2固体在20ml 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小 |
D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热,下列说法正确的是() 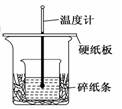
| A.如图条件下实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高。 |